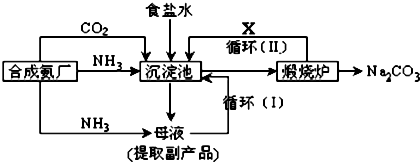
题目内容
5.一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如图一,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图二.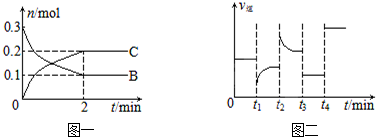
下列有关说法正确的是( )
| A. | t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大 | |
| B. | t1时改变的条件是降温,平衡逆向移动 | |
| C. | t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 | |
| D. | x=2,反应开始2 min内,v(B)=0.1 mol/(L•min) |
分析 根据图一可知,2min达平衡,△n(B)=0.3mol-0.1mol=0.2mol,△n(C)=0.2mol,根据物质的量变化量之比等于化学计量数之比计算x的值为2,
A.当增加c(C)的瞬间,正反应速率不变,逆反应速率增大,随着反应的进行,反应物浓度增大,正反应速率逐渐增大,增大生成物浓度,反应物转化率减小;
B.正反应为放热反应,当降低温度,平衡向着放热的反应方向移动;
C.反应前后气体的物质的量不变,减小压强,反应速率降低,平衡不移动;使用催化剂,加快反应速率,平衡不移动;
D.根据v=$\frac{\frac{△n}{V}}{△t}$计算反应开始2 min内v(B).
解答 解:由图1可知,2min达平衡,△n(B)=0.3mol-0.1mol=0.2mol,△n(C)=0.2mol,根据物质的量变化量之比等于化学计量数之比计算x的值为2,
A.当增加c(C)时的瞬间,反应物浓度不变,正反应速率不变,逆反应速率增大,平衡向着逆向移动,所以反应物浓度逐渐增大,正反应速率逐渐增大,故t2时正反应速率不变,之后逐渐增大,但增大生成物浓度时,反应物转化率减小,故A错误;
B.正反应为放热反应,当降低温度,反应正向移动,正逆速率都减小,并且正反应速度降低的幅度小,故B错误;
C.反应前后气体的物质的量不变,所以t3时减小压强,正逆反应速率同等程度降低,平衡不移动;t4时使用催化剂,同等程度加快反应速率,平衡不移动,故C正确;
D.通过图1可知,反应开始2 min内v(B)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05 mol/(L•min),故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率的计算、影响化学平衡移动的因素、转化率等知识,注意掌握化学反应速率概念及表达式,明确化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. | 酸性氧化物不一定都是非金属氧化物 | |
| B. | HCl、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |

其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;△\;\;}}{\;}$H2O(g)+Cl2(g)△H=△H1+△H2.(反应热用△H1和△H2表示).
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.
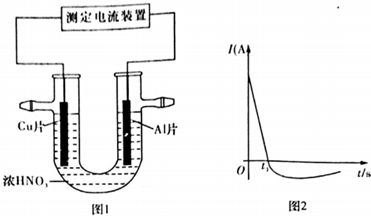
0~tl时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,tl时,原电池中电子流动方向发生改变,其原因是铝钝化后,铜成为负极.
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
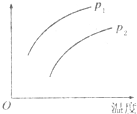 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
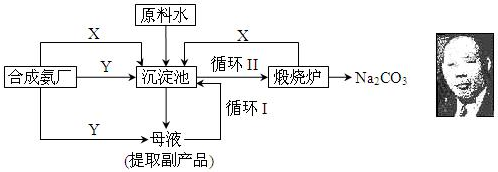
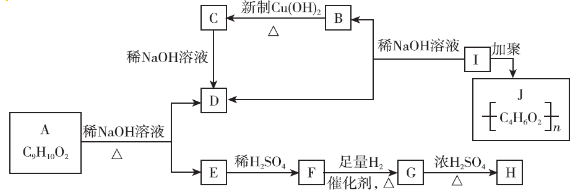
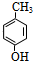 .
.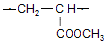 .
.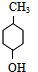 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$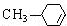 +H2O.
+H2O. .
.