题目内容
3.用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
分析 石蕊试液因颜色变化不明显,且变色范围过宽,一般不作滴定指示剂;强酸强碱相互滴定,可选用酚酞或甲基橙;由于氢氧化放置时间太长,在空气中与二氧化碳反应生成碳酸钠,盐酸与碳酸钠反应生成二氧化碳,根据饱和CO2溶液的pH为3.9,完全反应时溶液的pH为3.9,根据指示剂的变色范围,选出正确的指示剂.
解答 解:由于氢氧化放置时间太长,在空气中与二氧化碳反应生成碳酸钠,盐酸与碳酸钠反应生成二氧化碳,已知常温常压下,饱和CO2溶液的pH为3.9,甲基橙的变色范围为3.1-4.4,酚酞变色范围为8-10,所以选用甲基橙为指示剂;
滴定前将甲基橙加入放置时间较长的氢氧化钠溶液,溶液为碱性,呈黄色,当用盐酸滴定达到终点时,溶液变为橙色,滴定终点颜色变化为:由黄变橙,
故选C.
点评 本题考查了酸碱中和滴定中指示剂的选择及滴定终点现象,题目难度不大,注意学会根据不同的滴定反应选择合适的指示剂,并且能够正确判断滴定终点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.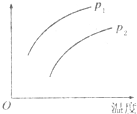 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
11.实验室配制80mL 1mol/L硫酸铜溶液,正确的操作是( )
| A. | 称量12.8gCuSO4溶解在100mL水中 | |
| B. | 称量25.0gCuSO4•5H2O晶体溶于100mL水中 | |
| C. | 称量16.0gCuSO4溶于水,然后稀释至100mL | |
| D. | 称量20.0gCuSO4•5H2O晶体溶于水,然后稀释至100mL |
18.下列有关氨或铵盐的说法不正确的是( )
| A. | NH3属于弱电解质 | |
| B. | 可用湿润的红色石蕊试纸检验氨气 | |
| C. | 用盐酸滴定氨水,当溶液呈中性时,c(NH4+)=c(Cl-) | |
| D. | 常温时,0.1mol•L-1NH4Cl溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的值不变 |
8.常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),
②2M2++R2═2M3++2R-
③2R-+Z2═R2+2Z-.
由此判断下列说法正确的是( )
①H++Z-+XO42-→X2++Z2+H2O(未配平),
②2M2++R2═2M3++2R-
③2R-+Z2═R2+2Z-.
由此判断下列说法正确的是( )
| A. | 氧化性强弱顺序为XO42->Z2>R2>M3+ | |
| B. | Z2在③中发生氧化反应 | |
| C. | R元素在反应②中被氧化,在③中被还原 | |
| D. | 常温下反应不可进行2M2++Z2═2M3++2Z- |
13.常温时由水电离产生的c(H+)=1×10-14 mol•L-1的溶液中,一定不能大量共存的离子组是( )
| A. | Al3+ NH4+ Br- SO42- | B. | Na+ Fe2+ Cl- NO3- | ||
| C. | K+ Ba2+ Cl- NO3- | D. | K+ Na+ SO42- SO32- |
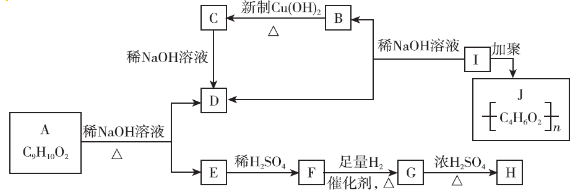
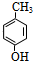 .
.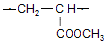 .
.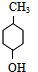 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$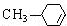 +H2O.
+H2O. .
.