题目内容
9.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )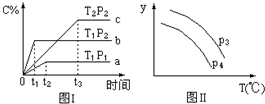
| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
分析 由图(Ⅰ)中a、b的相对位置知,增压(因p2>p1),C%升高,故x=1;由b、c的相对位置知,升温(因为T1>T2),C%降低.故正反应为放热反应.
即该反应为A(g)+B(g)?C(g)△H<0,由反应式可知,升温和降压均可使反应向逆反应方向移动.
由图Ⅱ,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,结合压强对平衡移动的影响判断P3、P4的关系.
解答 解:由图(Ⅰ)中a、b的相对位置知,增压(因p2>p1),C%升高,故x=1;由b、c的相对位置知,升温(因为T1>T2),C%降低.故正反应为放热反应,该反应为A(g)+B(g)?C(g)△H<0,由反应可知,升温和降压均可使反应向逆反应方向移动.
由图(Ⅱ)知:因随着温度升高y降低,故y降低的方向必为压强减小的方向,
A.P3>P4,随着温度的升高,平衡将向左移动,B的转化率降低,与图象一致,故A正确;
B.温度越高,B物质的转化率减小,所以B的体积分数增大,与图象不符,故B错误;
C.气体的质量、体积均不变,则密度始终不变,与图象不符,故C错误;
D.温度越高,平衡逆移气体总物质的量增大,所以气体的平均摩尔质量减小,但压强越大,平衡正向移动,平均摩尔质量变大,与图象不符,故D错误;
故选A.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图中物质的量的变化、平衡移动为解答的关键,侧重分析与应用能力的考查,注意比较温度及判断正反应为放热反应,题目难度不大.

练习册系列答案
相关题目
2.1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
| A. | C2H2 | B. | C3H4 | C. | C3H8 | D. | C4H6 |
20.(1)用O2将HC1转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;△\;\;}}{\;}$H2O(g)+Cl2(g)△H=△H1+△H2.(反应热用△H1和△H2表示).
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量浓度变化表示的反应速率1.8×10-3mol/(L•min).
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0~tl时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,tl时,原电池中电子流动方向发生改变,其原因是铝钝化后,铜成为负极.

其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;△\;\;}}{\;}$H2O(g)+Cl2(g)△H=△H1+△H2.(反应热用△H1和△H2表示).
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0~tl时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,tl时,原电池中电子流动方向发生改变,其原因是铝钝化后,铜成为负极.
17.下列说法正确的是( )
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
4.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是( )
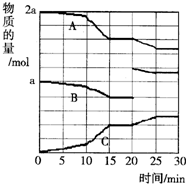

| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
14.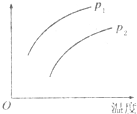 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
18.下列有关氨或铵盐的说法不正确的是( )
| A. | NH3属于弱电解质 | |
| B. | 可用湿润的红色石蕊试纸检验氨气 | |
| C. | 用盐酸滴定氨水,当溶液呈中性时,c(NH4+)=c(Cl-) | |
| D. | 常温时,0.1mol•L-1NH4Cl溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的值不变 |
19.在密闭容器中发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |