题目内容
Ⅰ.镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应.
如①CH2=CH2、②HC≡CH、③ 、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(3)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
(4)镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.NiO(OH)溶于浓盐酸的化学方程式为 .
Ⅱ.已知晶体CaF2结构如图Ⅰ所示,图Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合),金属铜形成晶体的结构如Ⅲ所示.

(5)图Ⅲ中铜原子形成的晶体中铜原子的配位数为 .
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是 ,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 .
(7)图I中CaF2晶体的密度为a g?cm-3,则晶胞的体积是 cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
(1)基态Ni原子的价电子(外围电子)排布式为
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应.
如①CH2=CH2、②HC≡CH、③
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有(3)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
(4)镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.NiO(OH)溶于浓盐酸的化学方程式为
Ⅱ.已知晶体CaF2结构如图Ⅰ所示,图Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合),金属铜形成晶体的结构如Ⅲ所示.

(5)图Ⅲ中铜原子形成的晶体中铜原子的配位数为
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是
(7)图I中CaF2晶体的密度为a g?cm-3,则晶胞的体积是
考点:晶胞的计算,原子核外电子排布,配合物的成键情况
专题:化学键与晶体结构
分析:(1)镍是28号元素,其原子核外有28个电子,3d、4s电子为其价电子,根据构造原理书写其价电子排布式;
(2)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式;根据价层电子对互斥理论判断甲醛的空间构型;
(3)离子晶体的熔点与离子半径成反比、与电荷成正比;
(4)NiO(OH)具有强氧化性,HCl具有还原性,二者发生氧化反应生成Ni 2+和氯气;
(5)金属铜采用面心立方最密堆积,其配位数=3×8×
;
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
(7)V=
.
(2)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式;根据价层电子对互斥理论判断甲醛的空间构型;
(3)离子晶体的熔点与离子半径成反比、与电荷成正比;
(4)NiO(OH)具有强氧化性,HCl具有还原性,二者发生氧化反应生成Ni 2+和氯气;
(5)金属铜采用面心立方最密堆积,其配位数=3×8×
| 1 |
| 2 |
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
(7)V=
| m |
| ρ |
解答:
解:(1)核外电子排布为[Ar]3d84s2,则价电子排布式是3d84s2,故答案为:3d84s2;
(2)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③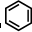 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(3)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(4)NiO(OH)具有强氧化性,HCl具有还原性,二者发生氧化反应生成Ni 2+和氯气,反应方程式为化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(5)金属铜采用面心立方最密堆积,其配位数=3×8×
=12,故答案为:12;
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体为分子晶体,受热熔化时,克服的微粒之间的相互作用为范德华力和氢键,故答案为:O;范德华力和氢键;
(7)该晶胞中F离子个数=8,钙离子个数=6×
+8×
=4,则V=
=
cm3=
cm3,
故答案为:
.
(2)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③
 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(3)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(4)NiO(OH)具有强氧化性,HCl具有还原性,二者发生氧化反应生成Ni 2+和氯气,反应方程式为化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(5)金属铜采用面心立方最密堆积,其配位数=3×8×
| 1 |
| 2 |
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体为分子晶体,受热熔化时,克服的微粒之间的相互作用为范德华力和氢键,故答案为:O;范德华力和氢键;
(7)该晶胞中F离子个数=8,钙离子个数=6×
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| ρ |
| ||
| a |
| 312 |
| aNA |
故答案为:
| 312 |
| aNA |
点评:本题考查较综合,涉及晶胞的计算、氧化还原反应、原子杂化方式的判断等知识点,晶胞的计算利用均摊法解答,原子杂化方式利用价层电子对互斥理论分析,这些知识点都是考试热点,要熟练掌握,题目难度中等.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列关于强弱电解质的叙述正确的是( )
| A、KCl溶液在电流作用下电离成K+和Cl- |
| B、SO2溶于水能部分转化成离子,故SO2属于弱电解质 |
| C、CaSO4微溶于水,所以CaSO4属弱电解质 |
| D、同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同 |
下列叙述,正确的是( )
A、人们使用
| ||||
| B、科学家们在过渡元素中寻找催化剂 | ||||
| C、目前周期表中的所有元素都是科学家们从自然界发现的 | ||||
| D、只有主族元素同时由短周期元素和长周期元素共同构成 |

 如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.