题目内容
(1)制备氢氧化铁胶体的方法是:往烧杯中沸腾的蒸馏水内逐滴滴入饱和的FeCl3溶液,当烧杯中液体成为红棕色时停止加热,这个变化可以用化学方程式表示为:FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl.证明得到的液体是氢氧化铁胶体的方法是 .
过滤所得到的氢氧化铁胶体,并用一束强光照射所得滤液,从垂直于光线的传播方向观察.该实验的目的是 .
(2)向盛有氢氧化钠溶液的烧杯中滴入饱和的FeCl3溶液,观察到有大量棕褐色的沉淀生成,得到的分散系属于 (“溶液”、“浊液”、“胶体”).这个变化可以用化学方程式表示为: .
将得到的分散系过滤,滤纸上有大量的固体物质,滤液呈浅黄棕色,用一束强光照射,能观察到明显的丁达尔现象.通过这个实验你能得出的结论是: .
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是: .
过滤所得到的氢氧化铁胶体,并用一束强光照射所得滤液,从垂直于光线的传播方向观察.该实验的目的是
(2)向盛有氢氧化钠溶液的烧杯中滴入饱和的FeCl3溶液,观察到有大量棕褐色的沉淀生成,得到的分散系属于
将得到的分散系过滤,滤纸上有大量的固体物质,滤液呈浅黄棕色,用一束强光照射,能观察到明显的丁达尔现象.通过这个实验你能得出的结论是:
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是:
考点:胶体的重要性质
专题:溶液和胶体专题
分析:(1)丁达尔效应可用于鉴别胶体,胶粒能透过滤纸;
(2)向FeCl3溶液中滴入NaOH溶液,二者之间会发生复分解反应;
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是分散质离子的大小.
(2)向FeCl3溶液中滴入NaOH溶液,二者之间会发生复分解反应;
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是分散质离子的大小.
解答:
解:(1)可以用丁达尔效应证明得到的液体是氢氧化铁胶体;溶液无丁达尔效应,过滤所得到的氢氧化铁胶体,有丁达尔效应,溶液无丁达尔效应,该实验的目的是测定氢氧化铁胶体粒子是否能够通过滤纸,故答案为:用一束强光照射,看是否有丁达尔现象;测定氢氧化铁胶体粒子是否能够通过滤纸;
(2)向FeCl3溶液中滴入NaOH溶液发生复分解反应:FeCl3+3NaOH═3NaCl+Fe(OH)3↓,得到氢氧化铁浊液,滤液有丁达尔效应,说明有胶体离子存在,故答案为:浊液;FeCl3+3NaOH=Fe(OH)3↓+3NaCl;该浊液中有胶体粒子存在;
(3)最本质的区别是氢氧化铁悬浊液中分散质微粒直径大于100nm,氢氧化铁胶体中分散质微粒直径在1nm~100nm之间,故答案为:氢氧化铁悬浊液中分散质微粒直径大于100nm,氢氧化铁胶体中分散质微粒直径在1nm~100nm之间.
(2)向FeCl3溶液中滴入NaOH溶液发生复分解反应:FeCl3+3NaOH═3NaCl+Fe(OH)3↓,得到氢氧化铁浊液,滤液有丁达尔效应,说明有胶体离子存在,故答案为:浊液;FeCl3+3NaOH=Fe(OH)3↓+3NaCl;该浊液中有胶体粒子存在;
(3)最本质的区别是氢氧化铁悬浊液中分散质微粒直径大于100nm,氢氧化铁胶体中分散质微粒直径在1nm~100nm之间,故答案为:氢氧化铁悬浊液中分散质微粒直径大于100nm,氢氧化铁胶体中分散质微粒直径在1nm~100nm之间.
点评:本题考查胶体、溶液、浊液的性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+,该反应的还原剂是( )
| A、Fe3+ |
| B、Cu |
| C、Fe2+ |
| D、Cu2+ |
黑火药爆炸时发生:S+2KNO3+3C=K2S+N2↑+3CO2↑,其中被还原的物质是( )
| A、S和KNO3 |
| B、C 和S |
| C、KNO3 |
| D、C 和KNO3 |
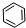 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有