题目内容
在一密闭的2L容器中装有4mol SO2和2mol O2,在一定条件下开始反应.2min末测得容器中有1.6mol SO2,请计算:
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率
(3)2min末SO2与O2的压强的比.
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率
(3)2min末SO2与O2的压强的比.
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:(1)计算参加反应的二氧化硫的物质的量,根据物质的量之比等于化学计量数之比计算生成的三氧化硫的物质的量,再根据c=
计算;
(2)根据v=
计算v(SO2);
(3)气体压强之比等于气体物质的量之比计算.
| n |
| V |
(2)根据v=
| ||
| △t |
(3)气体压强之比等于气体物质的量之比计算.
解答:
解:(1)2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,由方程式可知生成的三氧化硫的物质的量为2.4mol,故三氧化硫的浓度为
=1.2mol/L,
答:2min末SO3的浓度为1.2mol/L;
(2)v(SO2)=
=0.6 mol/(L.min),
答:2min内SO2的平均反应速率为0.6 mol/(L.min);
(3)2min末SO2与O2的压强的比等于气体物质的量之比,2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,依据化学方程式计算消耗氧气物质的量1.2mol,最后剩余氧气物质的量=2mol-1.2mol=0.8mol;
2min末SO2与O2的压强的比=1.6:0.8=2:1,
答:2min末SO2与O2的压强的比2:1.
| 2.4mol |
| 2L |
答:2min末SO3的浓度为1.2mol/L;
(2)v(SO2)=
| ||
| 2min |
答:2min内SO2的平均反应速率为0.6 mol/(L.min);
(3)2min末SO2与O2的压强的比等于气体物质的量之比,2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,依据化学方程式计算消耗氧气物质的量1.2mol,最后剩余氧气物质的量=2mol-1.2mol=0.8mol;
2min末SO2与O2的压强的比=1.6:0.8=2:1,
答:2min末SO2与O2的压强的比2:1.
点评:本题考查化学平衡有关计算、化学反应速率、浓度概念的计算,比较基础,注意气体压强之比等于气体物质的量之比.

练习册系列答案
相关题目
下列化学式中只能表示一种物质的是( )
| A、C3H7OH |
| B、CH2O2 |
| C、C4H6 |
| D、C3H6O2 |
下列事实不能用勒夏特列原理解释的是( )
| A、恒温密闭容器中NO2和N2O4形成的平衡体系,减小体积,体系颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、滴加酚酞的氨水中加入氯化铵固体后红色变浅 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
常温下,在pH=12的某碱溶液中,由水电离出的c(OH-)为( )
| A、1.0×10-7 mol/L |
| B、1.0×10-6 mol/L |
| C、1.0×10-3 mol/L |
| D、1.0×10-12 mol/L |
某有机物的结构简式为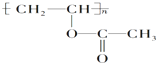 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A、1mol该有机物与NaOH溶液完全反应时,消耗NaOH 1mol |
| B、该有机物水解所得产物能发生取代反应 |
| C、该有机物可通过加聚反应生成 |
| D、该有机物的单体只有一种且能使溴水褪色 |
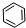 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有