题目内容
16.根据反应.Zn+H2SO4=ZnSO4+H2,回答下列问题.(1)氧化剂H2SO4,还原剂锌
(2)用单线桥法标明电子转移的方向和数目Zn+H2SO4═ZnSO4+H2
(3)氧化剂与还原剂的物质的量比1:1.
分析 该反应中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,据此分析解答.
解答 解:(1)反应Zn+H2SO4=ZnSO4+H2↑中,锌的化合价从0价升高到+2价,硫酸中氢的化合价从+1降到0价,Zn是还原剂,硫酸是氧化剂;
故答案为:H2SO4;Zn;
(2)Zn+H2SO4(稀)=ZnSO4+H2↑中,Zn元素的化合价升高,H元素非化合价降低,转移的电子数为2e-,电子转移的方向和数目为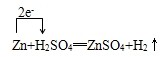 ,故答案为:
,故答案为: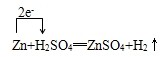 ;
;
(3)反应Zn+H2SO4=ZnSO4+H2↑中,锌的化合价从0价升高到+2价,硫酸中氢的化合价从+1降到0价,Zn是还原剂,硫酸是氧化剂,所以氧化剂与还原剂的物质的量比为1:1,故答案为:1:1.
点评 本题考查氧化还原反应,侧重考查基本概念及电子转移方向和数目,明确元素化合价变化即可解答,难点是标电子转移方向和数目.

练习册系列答案
相关题目
6.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A. | 溶液中有晶体析出,Na+数目不变 | |
| B. | 溶液中的OH- 物质的量浓度不变,有O2放出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液中NaOH的浓度减小,有O2放出 |
7.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.8 g D2O中含有的质子数、中子数均为NA | |
| B. | 标准状况下,22.4 L CCl4含有NA个CCl4分子 | |
| C. | 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
8.下列有关热化学方程式的叙述中,正确的是( )
| A. | 含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1)△H=-114.8kJ/mol | |
| B. | 已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol | |
| D. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.31kJ•mol-1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1 |
6.已知四苯甲烷的结构式如图,下列有关它的说法中正确的是( )
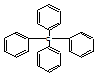

| A. | 它属于苯的同系物 | B. | 分子中所有原子共平面 | ||
| C. | 它的分子式为C25H24 | D. | 它的一氯代物有三种同分异构体 |