题目内容
4.向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体,过滤残留固体,干燥后称量,质量比加入的锌粉减轻了7.5g.试求:(1)加入铜片的质量.
(2)原硫酸的物质的量浓度.
分析 根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.
解答 解:设加入Cu片的量为xmol,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
xmol 2xmol xmol
CuSO4+Zn═ZnSO4+Cu
xmol xmol xmol
Zn+H2SO4═ZnSO4+H2↑
0.1mol 0.1mol 0.1mol
由Zn溶解,产生Cu质量减轻7.5g可得:65g/mol×(xmol+0.1mol)-64g/mol×xmol=7.5g
∴x=1,
∴加入铜片的质量为m(Cu)=1mol×64g/mol=64g
答:加入铜片的质量为64g.
(2)原 H2SO4的物质的量浓度 c(H2SO4)=$\frac{n}{V}$=$\frac{2×1mol+0.1mol}{0.115L}$=18.3mol/L
答:原硫酸的物质的量浓度为18.3mol/L.
点评 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.

练习册系列答案
相关题目
14.下列关于气体摩尔体积的叙述中,正确的是( )
| A. | 1 mol任何气体在标准状况下所占体积都约是22.4 L | |
| B. | 标准状况时,氧气的体积约是22.4 L | |
| C. | 1 mol任何气体的体积都约是22.4 L | |
| D. | 1 mol氢气和1 mol水含相同分子数,标准状况下体积都约是22.4 L |
15.一定温度下,两恒容容器中分别发生两个反应:①2X(g)+Y(g)?2Z(g);②A(g)+B(g)?C(g)+D(g),以下说法中,能说明反应①已经达到化学平衡状态、但不能说明反应②已经达到化学平衡状态的是( )
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |
19.常温时,将足量的AgCl分别加入下列各溶液中,AgCl的溶解度最小的是( )
| A. | 15mL 1.5 mol•L-1的AgNO3溶液 | B. | 10mL 2 mol•L-1的NaCl溶液 | ||
| C. | 5mL 1 mol•L-1的AlCl3溶液 | D. | 5mL 1.6mol•L-1的BaCl2溶液 |
9.羰基硫(COS)常用作粮食熏蒸剂,制取反应为CO(g)+H2S(g)?COS(g)+H2(g),△H<0.在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如表.下列说法错误的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | b | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 实验1反应开始到平衡整个过程中转移的电子的物质的量为6mol | |
| B. | 实验2达平衡时,a>7.0 | |
| C. | 实验3温度b>150 | |
| D. | 实验3 CO平衡转化率比实验1小 |
14.下列四种物质的结构图中,小黑球代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,示例:如 ),下列说法正确的是( )
),下列说法正确的是( )
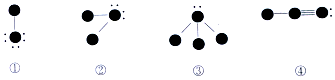
 ),下列说法正确的是( )
),下列说法正确的是( )
| A. | 四种物质中摩尔质量最大的是③ | B. | ①与③反应生成一种离子化合物 | ||
| C. | ④中含有非极性共价健 | D. | 该四种化合物涉及6种元素 |