题目内容
6.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )| A. | 溶液中有晶体析出,Na+数目不变 | |
| B. | 溶液中的OH- 物质的量浓度不变,有O2放出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液中NaOH的浓度减小,有O2放出 |
分析 过氧化钠与水反应生成氢氧化钠和氧气,消耗了水,但温度不变,NaOH的溶解度不变,因此所得NaOH溶液仍为饱和溶液,溶液的体积减小,以此分析.
解答 解:A.过氧化钠与水反应生成氢氧化钠,消耗了水,因此溶液中有NaOH晶体析出,Na+浓度不变,溶液体积减小,因此Na+数目减少,故A错误;
B.过氧化钠与水反应生成氢氧化钠和氧气,所得NaOH溶液仍为饱和溶液,所以溶液中溶液中的OH- 物质的量浓度不变,故B正确;
C.温度不变,所得NaOH溶液仍为饱和溶液,因此NaoH溶液的浓度不变,溶质的质量分数不变,故C错误;
D.温度不变,所得NaOH溶液的浓度不变,故D错误;
故选B.
点评 本题考查了溶液中的质量分数与物质的量浓度的关系,难度不大,明确温度不变,NaOH的溶解度不变是解题的关键.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
1.下列物质中,含有非极性共价键的离子化合物是( )
| A. | Na2O2 | B. | CO2 | C. | NaOH | D. | H2O2 |
14.下列关于气体摩尔体积的叙述中,正确的是( )
| A. | 1 mol任何气体在标准状况下所占体积都约是22.4 L | |
| B. | 标准状况时,氧气的体积约是22.4 L | |
| C. | 1 mol任何气体的体积都约是22.4 L | |
| D. | 1 mol氢气和1 mol水含相同分子数,标准状况下体积都约是22.4 L |
1.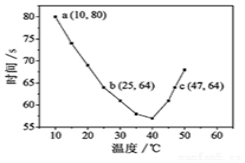 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 不能比较图中b、c两点对应的NaHSO3反应速率的大小 | |
| C. | 图中b点对应的NaHSO3反应速率为3.125×10-4mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该试验的指示剂 |
18.某温度下硫酸铜的溶解度是25g,若温度不变,将32g无水硫酸铜粉末放入mg水中,形成饱和溶液并有胆矾晶体析出时,则m的取值范围是( )
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤128g |
15.一定温度下,两恒容容器中分别发生两个反应:①2X(g)+Y(g)?2Z(g);②A(g)+B(g)?C(g)+D(g),以下说法中,能说明反应①已经达到化学平衡状态、但不能说明反应②已经达到化学平衡状态的是( )
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |