题目内容
19.利用乙醇的燃烧反应以氢氧化钠作电解质溶液设计一个燃料电池,则通入氧气的一极为正极(填“正极”“负极”),负极的电极反应式为C2H5OH-12e-+16OH-=2CO32-+11H2O.分析 在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子得还原反应.
解答 解:在燃料电池中,负极上是燃料乙醇发生失电子的氧化反应C2H5OH-12e-+16OH-=2CO32-+11H2O,正极上是氧气发生得电子得还原反应,
故答案为:正极;C2H5OH-12e-+16OH-=2CO32-+11H2O.
点评 本题考查学生燃料电池的放电规律知识,注意知识的积累是解题的关键,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
9.下列实验不用水浴加热的是( )
| A. | 实验室制乙烯 | B. | 苯的硝化 | C. | 银镜反应 | D. | 乙酸乙酯的制备 |
10.在强酸性的无色溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
7.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| B. | 含NA个H2SO4分子的浓硫酸与足量铜反应可制得0.5mol SO2 | |
| C. | 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA | |
| D. | 标准状况下,0.5mol NO和0.5mol O2组成的混合气体,体积约为22.4L |
4.为检验某化合物是否含碳、氢、氧三种元素,取一定质量该化合物在氧气中充分燃烧,接下来还须进行的实验有:①用带火星的木条检验氧气;②用无水硫酸铜检验是否有水生成;③用澄清石灰水检验是否有二氧化碳生成;④测定生成水和二氧化碳的质量.( )
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ②③ |
11.同一周期的X、Y、Z三种元素,已知最高价氧化物水化物酸性强弱是:HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物稳定性按X、Y、Z依次减弱 | |
| C. | 非金属性:X>Y>Z | |
| D. | 阴离子还原性:X-<Y2-<Z3- |
9.下列不能根据元素电负性判断元素( )
| A. | 是金属还是非金属 | B. | 正负化合价 | ||
| C. | 化学键类型 | D. | 化合物溶解度 |
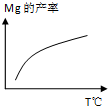 除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
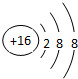 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).