题目内容
4.为检验某化合物是否含碳、氢、氧三种元素,取一定质量该化合物在氧气中充分燃烧,接下来还须进行的实验有:①用带火星的木条检验氧气;②用无水硫酸铜检验是否有水生成;③用澄清石灰水检验是否有二氧化碳生成;④测定生成水和二氧化碳的质量.( )| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ②③ |
分析 有机物燃烧生成二氧化碳和水,可用澄清石灰水检验二氧化碳,用无水硫酸铜检验水,以此确定C、H,结合生成水、二氧化碳的质量确定是否含有O,以此解答该题.
解答 解:硫酸铜是白色粉末遇到水会生成五水硫酸铜,变成蓝色,说明有水生成,即化合物中含有氢元素;
通过石灰水变浑浊了说明化合物中含有碳元素;
根据二氧化碳、水的质量可确定C、H的质量,对比有机物的质量可确定是否含有氧,
故选C.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意把握实验的原理,难度不大.

练习册系列答案
相关题目
14.如图所示高聚物的单体有几种( )


| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
12.将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色.此过程中二氧化硫表现出( )
| A. | 酸性 | B. | 还原性 | C. | 氧化性 | D. | 漂白性 |
9.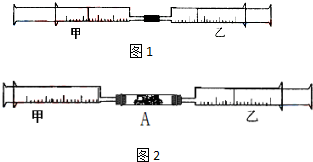 如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
(1)如果实验1甲针筒内改装15mL Cl2,乙针筒内仍为40mL NH3,实验时,甲针筒内也有白烟产生.写出有关反应的化学方程式.3Cl2+8NH3=N2+6NH4Cl
(2)由实验2可知,常温常压下氯气在水中的溶解度为1体积水溶解2体积氯气.
(3)实验3 反应后甲针筒内气体的体积为15ml~30ml.
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为0.8mol/L.
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如图2.在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体.将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半.A处的物质是Na2O2,甲针筒内的气体为O2.
(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出).乙针筒内装有50mL空气.实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL.
1)A处的物质是c(选填编号).
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
2)已知空气中氧气的体积分数为0.2,则该实验的相对误差为-5%.
 如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).
如图1所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定).| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40mL HCl | 40mL NH3 | 产生白烟 |
| 2 | 40mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30mL NO | 15mL O2 | |
| 4 | 20mL AlCl3溶液 | 10mL NaOH溶液 | 生成白色沉淀,后消失 |
(2)由实验2可知,常温常压下氯气在水中的溶解度为1体积水溶解2体积氯气.
(3)实验3 反应后甲针筒内气体的体积为15ml~30ml.
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为0.8mol/L.
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如图2.在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体.将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半.A处的物质是Na2O2,甲针筒内的气体为O2.
(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出).乙针筒内装有50mL空气.实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL.
1)A处的物质是c(选填编号).
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
2)已知空气中氧气的体积分数为0.2,则该实验的相对误差为-5%.
14.下列分子或离子中不能与质子结合的是( )
| A. | F- | B. | H2O | C. | NH4+ | D. | NH3 |