题目内容
7.A、B、C、D均为中学所学的常见物质且均含有同一中元素,它们之间的转化关系如图所示(反应条件及其它物质已经略去):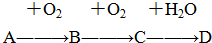
(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则将B通入KMnO4溶液的现象为紫红色变为无色;体现B的还原性(填“氧化性”“还原性”“漂白性”);请写出D的浓溶液与单质铜反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CuSO4+2H2O;此反应中作氧化剂的D与参加反应的D的物质的量之比为1:2;
(2)若A气体可使湿润的红色石蕊试纸变蓝,常温下D的浓溶液能使金属Fe、Al钝化,请写出实验室制备A的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;请写出C→D的离子方程式3NO2+H2O=2H++2NO3-+NO.
(3)若A是一种活泼金属,C是淡黄色固体,则C的名称为过氧化钠,试用化学方程式表示该物质与二氧化碳气体的反应2Na2O2+2CO2=2Na2CO3+O2;将C长期露置于空气中,最后将变成物质E,E的化学式为Na2CO3.
分析 (1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则A为S,B为SO2,C为SO3,D为H2SO4;
(2)若A气体可使湿润的红色石蕊试纸变蓝,A为NH3,常温下D的浓溶液能使金属Fe、Al钝化,D为HNO3,则B为NO,C为NO2;
(3)若A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,D为NaOH.
解答 解:(1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则A为S,B为SO2,C为SO3,D为H2SO4,
B为二氧化硫,具有还原性,可与高锰酸钾发生氧化还原反应,使高锰酸钾溶液褪色,浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CuSO4+2H2O,由方程式可知此反应中作氧化剂的D(H2SO4)与参加反应的D(H2SO4)的物质的量之比为1:2,
故答案为:紫红色变为无色;还原性;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CuSO4+2H2O;1:2;
(2)若A气体可使湿润的红色石蕊试纸变蓝,A为NH3,常温下D的浓溶液能使金属Fe、Al钝化,D为HNO3,则B为NO,C为NO2,实验室制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,C→D的离子方程式:3NO2+H2O=2H++2NO3-+NO,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;3NO2+H2O=2H++2NO3-+NO;
(3)若A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,D为NaOH,C的名称为过氧化钠,与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,将C长期露置于空气中,与空气中二氧化碳、水蒸气反应,氢氧化钠会稀释二氧化碳,最终生成碳酸钠,
故答案为:过氧化钠;2Na2O2+2CO2=2Na2CO3+O2;Na2CO3.
点评 本题考查元素化合物的推断,涉及S、N元素单质及其化合物性质与转化,难度中等,需要学生熟练掌握元素化合物知识,注意相关知识的归纳.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH(CH3)CHO |
| A. | 达到化学平衡时,n(CO2):n(NH3)=1:1 | |
| B. | 达到化学平衡时,n(CO2):n(H20)=1:1 | |
| C. | 达到化学平衡时,n[CO(NH2)2]:n(H20)=1:1 | |
| D. | 达到化学平衡时,n(NH3):n(H20)=1:1 |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W含氧酸的酸性一定比Z的含氧酸的酸性强 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
| A. | F2 | B. | Cl- | C. | NH3 | D. | NH2- |
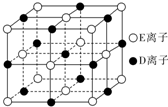 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.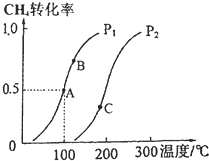 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).