��Ŀ����
13��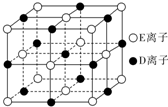 A��B��C��D��E��FΪǰ������Ԫ����ԭ������������������A����3���ܼ�����ÿ���ܼ������ĵ�������ͬ��C���������6���˶�״̬��ͬ�ĵ��ӣ�D�Ƕ�����Ԫ���е縺����С��Ԫ�أ�E������������Ӧ��ˮ����������ǿ��F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�GԪ����DԪ��ͬ���壬�����3�����ڣ�
A��B��C��D��E��FΪǰ������Ԫ����ԭ������������������A����3���ܼ�����ÿ���ܼ������ĵ�������ͬ��C���������6���˶�״̬��ͬ�ĵ��ӣ�D�Ƕ�����Ԫ���е縺����С��Ԫ�أ�E������������Ӧ��ˮ����������ǿ��F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�GԪ����DԪ��ͬ���壬�����3�����ڣ���1��Ԫ��E����ۺ����������ǿ��Ԫ��B�����÷��ӽṹ�����۽���ԭ����������з��ǻ�����Ŀ����������ӣ����¸�������Cl-O-H�е��ӶԸ���ƫ����Cl�������ˮ���ӵ������£���������������H+���ʸ���������ǿ��
��2��F�ľ���Ķѻ���ʽΪ�����������ܶѻ���
��3��D��E��G��E�γɵľ���������ͬ�����������λ����ͬ����ԭ�����������Ӱ뾶�Ȳ�ͬ��
��4����֪DE����ľ�����ͼ��ʾ������DE�����е�����E����ȥ��������D����ȫ����ΪAԭ�ӣ��������е�4����С�����塱���ĸ�����һ��Aԭ�ӣ�����4����С�����塱�����ڣ�λ�ڡ�С�����塱�е�Aԭ���������4��Aԭ���Ե����������ɴ˱�ʾA��һ�־���ľ�������֪A-A���ļ���Ϊa cm��NA��ʾ�����ӵ�����������þ����к���8��Aԭ�ӣ��þ�����ܶ���$\frac{9\sqrt{3}}{2{a}^{3}{N}_{A}}$g/cm3��
���� A��B��C��D��E��FΪǰ������Ԫ����ԭ������������������A����3���ܼ�����ÿ���ܼ������ĵ�������ͬ������ԭ�Ӻ�������Ų�Ϊ1s22s22p2����AΪCԪ�أ�D�Ƕ�����Ԫ���е縺����С��Ԫ�أ���DΪNaԪ�أ�C���������6���˶�״̬��ͬ�ĵ��ӣ����ڢ�A�壬���ԭ��������֪CΪOԪ�أ���BΪNԪ�أ�E������������ˮ����������ǿ����EΪCl��F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d104s1����FΪCu��GԪ����DԪ��ͬ���壬�����3�����ڣ���GΪCs���Դ˽����⣮
��� �⣺A��B��C��D��E��FΪǰ������Ԫ����ԭ������������������A����3���ܼ�����ÿ���ܼ������ĵ�������ͬ������ԭ�Ӻ�������Ų�Ϊ1s22s22p2����AΪCԪ�أ�D�Ƕ�����Ԫ���е縺����С��Ԫ�أ���DΪNaԪ�أ�C���������6���˶�״̬��ͬ�ĵ��ӣ����ڢ�A�壬���ԭ��������֪CΪOԪ�أ���BΪNԪ�أ�E������������ˮ����������ǿ����EΪCl��F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�F�������ԭ�ӹ�����ڰ����״̬�������ܲ���������ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d104s1����FΪCu��GԪ����DԪ��ͬ���壬�����3�����ڣ���GΪCs��
��1������������Ա�����ǿ��ԭ���Ǹ���������з��ǻ�����Ŀ����������ӣ����¸�������Cl-O-H�е��ӶԸ���ƫ����Cl�������ˮ���ӵ������£���������������H+���ʸ���������ǿ��
�ʴ�Ϊ������������з��ǻ�����Ŀ����������ӣ����¸�������Cl-O-H�е��ӶԸ���ƫ����Cl�������ˮ���ӵ������£���������������H+���ʸ���������ǿ��
��2��FΪCu����Ӧ�ľ���Ϊ�����������ܶѻ����ʴ�Ϊ�������������ܶѻ���
��3��NaCl��CsCl���־��壬���������Ӿ��壬�����������ӵİ뾶�Ȳ�ͬ�������ǵ���λ����ͬ���ʴ�Ϊ���������Ӱ뾶�Ȳ�ͬ��
��4��NaCl����ľ����е�����Cl-����ȥ��������Cl-����ȫ����ΪC��̼��ԭ�ӣ��������е�4����С �����塱���ĸ�����һ��C��̼��ԭ�ӣ�����4����С�����塱�����ڣ�λ�ڡ�С�����塱�е�Cԭ���������4��Cԭ���Ե����������γ���������ṹ��������C��̼��ԭ����Ŀ=4+8��$\frac{1}{8}$+6��$\frac{1}{2}$=8����������=8��$\frac{12g}{{N}_{A}}$��C-C���ļ��� Ϊa cm����ͼ�������� ������F��A��B��C��D��������A-BCD����Ϊ��4�����������������V����A-BCD=4V����F-BCD=����$\frac{1}{3}$S��BCD•��a+h��=4��$\frac{1}{3}$S��BCD•h����h=$\frac{1}{3}$a��������������ⳤΪx cm������AF���ӳ���������BCD��O��OΪ��������BCD�����ģ�BO��ֱƽ��CD����BO�ij���=x cm��$\frac{\sqrt{3}}{2}��\frac{2}{3}$=$\frac{\sqrt{3}}{3}$xcm����ֱ��������BOF�У�$��\frac{\sqrt{3}}{3}x��^{2}+��\frac{1}{3}a��^{2}$=a2�����x=$\frac{2\sqrt{6}a}{3}$�ʾ������ⳤ=$\frac{\sqrt{2}}{2}$��2xcm=$\frac{\sqrt{2}}{2}��2��\frac{2\sqrt{6}a}{3}$cm=$\frac{4\sqrt{3}a}{3}$cm���ʾ��������=$��\frac{4\sqrt{3}}{3}a��^{3}$=$\frac{64}{3\sqrt{3}}{a}^{3}$cm3�����ܶ�=$\frac{8��\frac{12g}{{N}_{A}}}{\frac{64}{3\sqrt{3}}{a}^{3}}$=$\frac{9\sqrt{3}}{2{a}^{3}{N}_{A}}$g•cm-3��
������F��A��B��C��D��������A-BCD����Ϊ��4�����������������V����A-BCD=4V����F-BCD=����$\frac{1}{3}$S��BCD•��a+h��=4��$\frac{1}{3}$S��BCD•h����h=$\frac{1}{3}$a��������������ⳤΪx cm������AF���ӳ���������BCD��O��OΪ��������BCD�����ģ�BO��ֱƽ��CD����BO�ij���=x cm��$\frac{\sqrt{3}}{2}��\frac{2}{3}$=$\frac{\sqrt{3}}{3}$xcm����ֱ��������BOF�У�$��\frac{\sqrt{3}}{3}x��^{2}+��\frac{1}{3}a��^{2}$=a2�����x=$\frac{2\sqrt{6}a}{3}$�ʾ������ⳤ=$\frac{\sqrt{2}}{2}$��2xcm=$\frac{\sqrt{2}}{2}��2��\frac{2\sqrt{6}a}{3}$cm=$\frac{4\sqrt{3}a}{3}$cm���ʾ��������=$��\frac{4\sqrt{3}}{3}a��^{3}$=$\frac{64}{3\sqrt{3}}{a}^{3}$cm3�����ܶ�=$\frac{8��\frac{12g}{{N}_{A}}}{\frac{64}{3\sqrt{3}}{a}^{3}}$=$\frac{9\sqrt{3}}{2{a}^{3}{N}_{A}}$g•cm-3��
�ʴ�Ϊ��8��$\frac{9\sqrt{3}}{2{a}^{3}{N}_{A}}$��
���� ���⿼�����ʽṹ�����ʣ�Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬�ƶ�Ԫ���ǽ���ؼ���ע������Ԫ�������ɣ���4�����ܶȼ���Ϊ�״��㡢�ѵ㣬��Ҫѧ���߱�һ������д�����������ѶȽϴ�

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�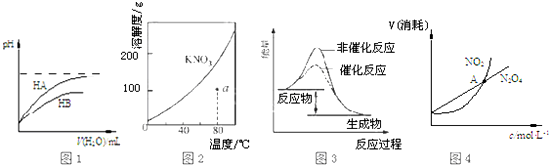
| A�� | ͼ1��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pHС��ͬŨ�ȵ�NaB��Һ��pH | |
| B�� | ͼ2��ʾ KNO3���ܽ�����ߣ�a����ʾ����Һ��80��ʱKNO3�IJ�������Һ | |
| C�� | ͼ3 ��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯 | |
| D�� | ͼ4��ʾ���º��������£�2NO2��g��?N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬ |
��NH3���ۡ��е��VA������Ԫ���⻯����ۡ��е��
��С���ӵĴ���������Ժ�ˮ������Ȼ���
�����ǻ���������ۡ��е�ȶ��ǻ���������ۡ��е��
��ˮ���Ӹ�����Ҳ���ȶ���ˮ���ӽ���������ȶ���
| A�� | �٢ڢۢ� | B�� | �ܢ� | C�� | �ۢܢ� | D�� | �٢ڢ� |
 ���������ش����������ƺͶ��ȷӣ�
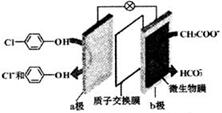
���������ش����������ƺͶ��ȷӣ�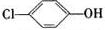 ���ķ�ˮ������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
���ķ�ˮ������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �缫b������ | B�� | ���Ӵ�a������b�� | ||
| C�� | ������ķ�ˮpH���� | D�� | a���ĵ缫��Ӧʽ�� |
���ٶ�����̼���ŷ���һ����Ҫ���⣮�о�������C02��������ɺϳɵ�̼����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H���ֻ�ѧ���ļ��������ʾ
| ��ѧ�� | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| ����/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
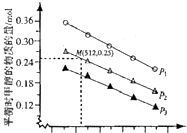
��2����1.0L�����ܱ�������Ͷ��lmolC02��2.75molH2�����÷�Ӧ��ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ���������ʵ�����ͼ��ʾ��
��ѹǿΪP2���¶�Ϊ512Kʱ�����������Ͷ�� lmol CO2��0.5mol H2��2mol CH3OH��0.6mol H20ʱ��ƽ�����淴Ӧ�����ƶ���
��3����CH3OH��������02����20%����KOH��ҺΪ ԭ�ϣ���ʯīΪ�缫��ֱ�ӹ���ȼ�ϵ�أ���õ�صĸ�����ӦʽΪCH3OH+8OH--6e-=CO32-+6H2O���ø� ��ص��500mL 1mol/L CuSO4��Һ����ȼ�ϵ�����ı����56L����ʱ��������������������������������ʵ���1mol��
��SO2Ҳ��һ�ִ�����Ⱦ������ú�ˮ������SO2�ķ�������ˮ����Ҫ���ӵĺ������£�
| �ɷ� | ����/��mg/L�� | �ɷ� | ������mg/L�� |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-�� | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
��֪Ksp[Mg��OH��2]=1.2��l0-11 Ksp[Ca��OH��2]=5.5��10-6
��2���������ķ�����S02�ĺ�������ͨ�����������ⶨ���õ����Լ��У�0��l mol•L�ĵ����Һ��������Һ�����Ѵ�����ķ�����ÿ����aL������£�������ͨ�뵽lOOmL���е��۵ĵ��Һ�У�t min�ﵽ�ζ��յ㣮�ζ��յ������Ϊ��Һ��ɫ��ȥ���Ұ���Ӳ��ָ���ɫ����ô�������SO2�ĺ���$\frac{0.224}{at}$���ú�a��t��ʽ�ӱ�ʾ��
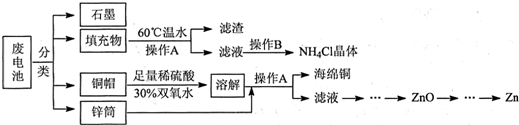
 ��ʾ�ķ���ʽΪC6H14��������2-�����飮
��ʾ�ķ���ʽΪC6H14��������2-�����飮 �к��еĹ����ŵ�����Ϊ�ǻ���������
�к��еĹ����ŵ�����Ϊ�ǻ���������