题目内容
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
分析 A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性;
B.使pH试纸显蓝色的溶液,显碱性;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液;
D.pH=0的溶液,显酸性,离子之间结合生成络离子.
解答 解:A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.使pH试纸显蓝色的溶液,显碱性,不能大量存在NH4+,故B错误;
C.由水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液,碱溶液中不能大量存在Mg2+,故C错误;
D.pH=0的溶液,显酸性,Fe3+、SCN-结合生成络离子,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应、络合反应的离子共存考查,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
2.环境问题已经是我国面临的重大问题.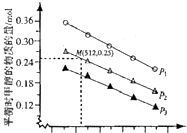
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H几种化学键的键能如表所示
通过计算得出△H=-28kJ/mol.
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该 电池电解500mL 1mol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
(1)海水经初步处理后,还含有Ca2+、Mg2+,Na+、Cl-,向其中加入石灰浆使海水中的Mg2+转换 为Mg(OH)2,当Mg2+刚好沉淀完全时,c( Ca2+)为4.58mol/L
已知Ksp[Mg(OH)2]=1.2×l0-11 Ksp[Ca(OH)2]=5.5×10-6
(2)处理过的废气中S02的含量可以通过碘量法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中SO2的含量$\frac{0.224}{at}$(用含a,t的式子表示)

Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该 电池电解500mL 1mol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2×l0-11 Ksp[Ca(OH)2]=5.5×10-6
(2)处理过的废气中S02的含量可以通过碘量法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中SO2的含量$\frac{0.224}{at}$(用含a,t的式子表示)
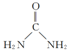
4.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量642kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(1)△H=-642.0kJ/mol.
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol
则CO与SO2反应的热化学方程式是2CO(g)+SO2(g)=CO2(g)+S(s)△H=-270kJ/mol.
(3)硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.下列各组实验中最先出现浑浊的是D(填字母代号).
(4)已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol,实验室用0.25L0.10mol/L的一元强酸和强碱恰好完全中和,若中和后溶液体积为500mL,其溶液的比热容为4.2×10-3kJ/(g•℃),且密度近似为1.0g/mL,则溶液温度升高了0.68℃.(结果保留两位小数)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol
则CO与SO2反应的热化学方程式是2CO(g)+SO2(g)=CO2(g)+S(s)△H=-270kJ/mol.
(3)硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.下列各组实验中最先出现浑浊的是D(填字母代号).
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
11.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增加1倍,达到新的平衡后,B的浓度是原来的40%,则( )
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率变大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
1.下列有关叙述正确的是( )
| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
 .
.