题目内容
8.常温下,0.1mol/L的氢氧化钠溶液pH=1,取10mL 0.1mol/L的氢氧化钠溶液,将其稀释到100mL,稀释后所得氢氧化钠溶液的浓度为0.01mol/L、pH=12.常温下将pH=12的氢氧化钡溶液稀释1000倍,稀释后所得氢氧化钡溶液的pH=9.常温下将pH=9的氢氧化钠溶液稀释1000倍,稀释后所得氢氧化钠溶液的pH7.分析 pH=-lgc(H+),溶液稀释时,满足c浓V浓=c稀V稀,稀释前后溶质的物质的量不变,无论是酸溶液还是碱溶液,稀释时浓度减小,但溶液的酸、碱性不可能改变,以此解答该题.
解答 解:常温下,0.1mol/L的氢氧化钠溶液pH=-lg0.1=1,
取10mL 0.1mol/L的氢氧化钠溶液,将其稀释到100mL,稀释后所得氢氧化钠溶液的浓度为$\frac{10×0.1}{100}$mol/L=0.01mol/L,则c(H+)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,pH=12,
将H=12的氢氧化钡溶液中c(OH-)=0.01mol/L,稀释1000倍,则c(OH-)=10-5mol/L,则c(H+)=10-9mol/L,pH=9,
常温下将pH=9的氢氧化钠溶液稀释1000倍,稀释后所得氢氧化钠溶液的pH≈7,
故答案为:1;0.01mol/L;12;9;7.
点评 本题考查了pH的有关计算,为高频考点,侧重考查学生的分析、计算能力,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键,题目难度不大,注意常温下将pH=9的氢氧化钠溶液稀释1000倍,pH不可能变为6,因此时不能忽视水的电离,为易错点.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
6.反应A(g)+2B(g)?C(g)+D(g)+QKJ的能量变化如图所示,有关叙述正确的是( )
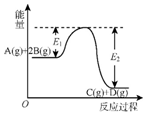

| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
19.室温下pH值相同的下列溶液中,浓度最大的是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | NaOH | D. | CH3COONa |
16.下列关于物质的检验,说法正确的是( )
| A. | 向无色溶液中加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 滴加硝酸化的AgNO3溶液后产生白色沉淀,说明该溶液一定含有Cl- | |
| D. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
3.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
13.下列混合气体除杂质操作正确的是( )(括号内为杂质).
| A. | CO2(HCl):将气体通入饱和Na2CO3溶液中 | |
| B. | Cl2(HCl):将气体通入饱和食盐水中 | |
| C. | NO2(NO):将气体通入水中 | |
| D. | CO2(SO2):将气体通入澄清石灰水中 |
20.对下列实验的评价,正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42- | |
| B. | 某无色溶液中滴入紫色石蕊试液显红色,该溶液可能有 CO 32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 Ba2+ | |
| D. | 验证烧碱溶液中是否含有 Cl-,先加稍过量的稀硝酸除去 OH-,再加入 AgNO3溶液,如有 白色沉淀,则证明有 Cl- |
17.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |
18.下列说法正确的是( )
| A. | 用分液漏斗分离饱和食盐水与醇的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后必须烘干才能进行溶液的配制 | |
| C. | 分馏石油时,温度计的水银求必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时即停止加热 |