题目内容
6.反应A(g)+2B(g)?C(g)+D(g)+QKJ的能量变化如图所示,有关叙述正确的是( )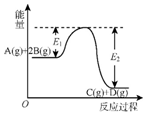
| A. | Q=E2 | |
| B. | 在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 | |
| C. | Q>0,升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大 |
分析 由图象可知反应物总能量大于生成物总能量,则正反应为放热反应,升高温度,正逆反应速率都增大,平衡逆向移动,由于反应物气体的计量数之和大于生成物,则增大压强,平衡正向移动,以此解答该题.
解答 解:A.反应热=反应物的总键能-生成物的总键能,则Q=E2-E1,故A错误;
B.催化剂使正逆反应的活化能都降低,反应速率加快,则E1减小,E2减小,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.缩小体积,虽然平衡正向移动,但由于体积减小,反应物、生成物的浓度都增大,故D正确.
故选D.
点评 本题考查了反应热和焓变的分析判断,为高频考点,侧重考查学生的分析能力,图象分析是解题关键,理解反应热的计算方法,注意知识积累,题目较简单.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数 | |
| B. | 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数 | |
| C. | 升高温度,可以增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
17.在常温下,分别利用下列反应产生氢气,其反应方程式分别为:
①2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O
②KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O
如果上述两个反应所产生的氯气质量相等,被氧化的还原剂的物质的量之比为( )
①2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O
②KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O
如果上述两个反应所产生的氯气质量相等,被氧化的还原剂的物质的量之比为( )
| A. | 8:5 | B. | 6:5 | C. | 2:1 | D. | 1:1 |
14.实验时研究化学的基础,图中所示的实验操作正确的是:实验时研究化学的基础,图中所示的实验操作正确的是:( )
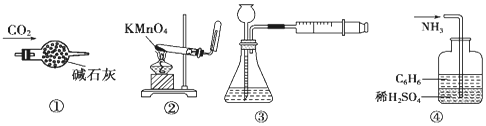

| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
1.一定条件下,在体积为10L的密闭容器中,1molA和1molB进行反应:2A(g)+B(g)?2C(g),达到平衡时生成0.6molC.下列说法正确的是( )
| A. | 当容器内密度保持不变时,可以判断反应已达平衡 | |
| B. | 其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍 | |
| C. | 其他条件不变.若增大压强,则物质A的转化率减小 | |
| D. | 达到平衡时,C的体积百分含量为35.3% |
11.在一定温度下,向aL密闭的容器中加入1 molX气体和1 molY气体,发生如下反应:X(g)+Y(g)?2Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |
7.将下列离子:Al3+、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、AlO2-、CO32-按可能大量共存的情况,把它们全部分成A、B两组,而且每组中都含有不少于两种阳离子和两种阴离子.下列离子不会同在一组的是( )
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
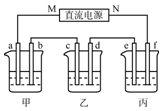 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.