题目内容
16.下列关于物质的检验,说法正确的是( )| A. | 向无色溶液中加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 滴加硝酸化的AgNO3溶液后产生白色沉淀,说明该溶液一定含有Cl- | |
| D. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
分析 A.白色沉淀为AgCl或硫酸钡;
B.焰色反应为元素的性质,火焰呈黄色,可知一定含Na元素;
C.白色沉淀为AgCl或硫酸银等;
D.滴加KSCN溶液,溶液不变色,可知不含铁离子,滴加氯水后溶液显红色,可知亚铁离子被氧化为铁离子.
解答 解:A.白色沉淀为AgCl或硫酸钡,则原溶液中可能含SO42-,故A不选;
B.焰色反应为元素的性质,火焰呈黄色,可知一定含Na元素,溶液可能为钠盐、NaOH等,故B不选;
C.白色沉淀为AgCl或硫酸银等,则该溶液中可能含有Cl-,故C不选;
D.滴加KSCN溶液,溶液不变色,可知不含铁离子,滴加氯水后溶液显红色,可知亚铁离子被氧化为铁离子,则该溶液中一定含Fe2+,故D选;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
相关题目
14.实验时研究化学的基础,图中所示的实验操作正确的是:实验时研究化学的基础,图中所示的实验操作正确的是:( )
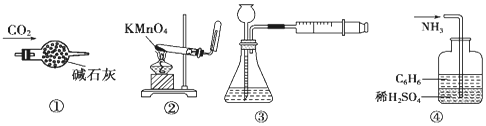

| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
7.将下列离子:Al3+、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、AlO2-、CO32-按可能大量共存的情况,把它们全部分成A、B两组,而且每组中都含有不少于两种阳离子和两种阴离子.下列离子不会同在一组的是( )
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
4.下列有关物质的性质和用途的说法正确的是( )
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |
11.科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,空气为氧化剂,电解质是固态氧化物,在熔融状态下能传导O2-; 该电池的总反应是C3H8+5O2═3CO2+4H2O,负极反应为C3H8-20e-+10O2-═3CO2+4H2O.下列关于该燃料电池的说法中正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的正极通入丙烷 | |
| C. | 电路中每通过5 mol 电子,约有5.6 L标准状况下的丙烷被完全氧化 | |
| D. | 在电池正极的电极反应为O2-4e-═2O2- |
1.氨气是一种重要的化工产品,是生产铵盐、尿素等原料,工业合成氨的反应如下:
N2(g)+3H2(g)?2NH3(g)△H=一92.4KJ•mol-1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为$\frac{a}{100V}$mol•L-1.(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]:
CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3.反应中CO2( g)的物质的量随时间变化如表所示:
①20min时,υ正(CO2 )>80min时.υ逆(H2O)(填“>”、“=”或“<”).在t℃时,该反应额平衡常数表达式为K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$;
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).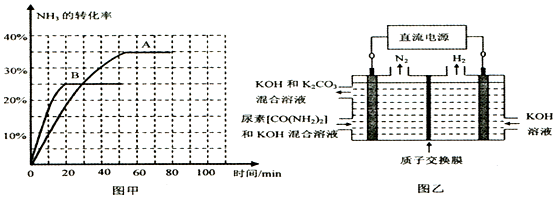
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,若两极共收集到气体22.4L(标况),则消耗的尿素为15g(忽略气体的溶解).
N2(g)+3H2(g)?2NH3(g)△H=一92.4KJ•mol-1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为$\frac{a}{100V}$mol•L-1.(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]:
CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3.反应中CO2( g)的物质的量随时间变化如表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).

⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,若两极共收集到气体22.4L(标况),则消耗的尿素为15g(忽略气体的溶解).
6.向盛有不同试剂的试管b中分别滴加适量0.1mol/L FeCl3 溶液,下列对b中现象的解释正确的是( )
| 实验 | b中物质 | b中现象 | 结论或解释 | |
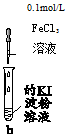 | A | Mg(OH)2悬浊液 | 有红棕色胶体产生 | 发生反应:Fe3++3OH-═Fe(OH)3(胶体) |
| B | Cu粉 | 溶液变蓝,试管底部有固体 | 溶液变蓝的原因是:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C | 5%H2O2溶液 | 有气泡生成 | 该气体为氯气,双氧水强氧化性氧化Cl-产生 | |
| D | 饱和NaHCO3溶液 | 有气泡生成,且试管底部有固体 | 发生反应:Fe3++3HCO3-═Fe(OH)3+3CO2 |
| A. | A | B. | B | C. | C | D. | D |