题目内容
2.草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
分析 (1)草酸是二元弱酸,其分部电离;
(2)根据溶液中的物料守恒分析;
(3)反应速率与温度、浓度都成正比;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据草酸和高锰酸钾之间的关系式计算草酸的物质的量,再根据质量分数公式计算其纯度;
(5)根据c(Mg2+)•c(C2O42-)与溶度积常数相对大小判断是否完全沉淀,如果c(Mg2+)•c(C2O42-)小于溶度积常数,则完全沉淀.
解答 解:(1)草酸(H2C2O4)是一种二元弱酸,其分部电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)浓度为0.1mol/L的Na2C2O4溶液中存在物料守恒,即:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L;
故答案为:0.1;
(3)反应速率与温度、浓度都成正比,二者的温度和浓度都相等,则反应速率相等,则反应速率相等,则褪色时间相等,故答案为:40s;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
设草酸的物质的量为xmol,则:
5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O
5mol 2mol
x 0.0500mol•L-1×0.015L
所以,5mol:2mol=x:0.0500mol•L-1×0.015L
解得x=0.001875mol,
故其纯度=$\frac{0.001875mol×126g/mol}{0.25g}$×100%=94.5%,
故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;94.5%;
(5)1L 0.01mol/LMgCl2溶液中的Mg2+的物质的量是0.01mol,100 mL0.1 mol/L的(NH4)2C2O4溶液的物质的量也是0.01mol,即二者恰好反应.根据溶解平衡MgC2O4(s)?Mg2+(aq)+C2O42-(aq)可知c(Mg2+)•c(C2O42-)=Ksp=8.1×10-5,因为c(Mg2+)=c(C2O42-),所以c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L,故Mg2+未沉淀完全,
故答案为:否.
点评 本题考查了弱电解质的电离、难溶物的溶解平衡、盐类水解等知识点,根据弱电解质的电离特点、溶度积常数、盐类水解特点来分析解答即可,题目难度中等,侧重于考查学生的分析能力和计算能力.

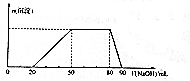 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
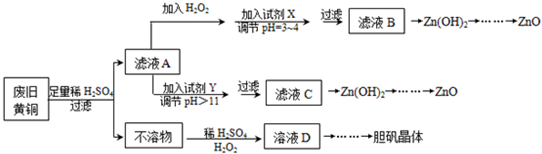
已知:①Zn及化合物性质与Al及化合物性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.
②下表为几种离子生成氢氧化物沉淀的pH(开始沉淀时金属离子浓度为1.0mol•L-1).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(2)调节pH=3~4的试剂X可以用AC:
A.ZnO B.NaOH C.Zn(OH)2 D.ZnSO4
调节pH=3~4的目的是使Fe3+转化为Fe(OH)3,达到除去Fe3+的目的.
(3)往滤液A中加的Y试剂可以是B:
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
(4)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤、晾干.
(6)测定胆矾晶体纯度(不含能与I-反应的杂质):准确称取0.5000g胆矾晶体置于锥形瓶,加适量水溶解,再加过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.60mL,离子反应为:
2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为98.00%.
②若滴定前仰视、滴定后俯视滴定管读数,所测纯度将会偏低(填“偏高”、“偏低”或“不变”).
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 二氧化碳、甲烷、氮气都是造成温室效应的气体 | |
| C. | 在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 | |
| D. | 石油裂解、煤的气化、海水制镁都包含化学变化 |
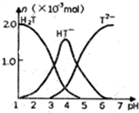 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |