题目内容
14.化学与生产生活、社会发展密切相关,下列有关说法不正确的是( )| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 二氧化碳、甲烷、氮气都是造成温室效应的气体 | |
| C. | 在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念 | |
| D. | 石油裂解、煤的气化、海水制镁都包含化学变化 |
分析 A.作原电池负极的金属易被腐蚀;
B、二氧化碳、甲烷都是造成温室效应的气体;
C、在较低温度和压强下能使反应迅速进行的催化剂可以加快反应速率;
D、石油裂解大分子分解为小分子、煤的气化是碳和水反应生成氢气和一氧化碳气体、海水制镁通过沉淀提取,蒸发结晶,电解得到镁都包含化学变化.
解答 解:A.铜、铁和电解质溶液能构成原电池,铁作负极,因为铁易失去电子而被腐蚀,故A正确;
B、二氧化碳、甲烷都是造成温室效应的气体,氮气不是造成温室效应的气体,故B错误;
C、在较低温度和压强下能使反应迅速进行的催化剂可以加快反应速率,则减少了能源的使用,能体现十八大提出的“绿色发展”理念,故C正确;
D、石油裂解大分子分解为小分子、煤的气化是碳和水反应生成氢气和一氧化碳气体、海水制镁通过沉淀提取,蒸发结晶,电解得到镁,过程中都包含有化学反应,故D正确;
故选B.
点评 本题考查较为综合,涉及温室效应、催化剂对反应速率的影响等,为高频考点,侧重于学生的分析能力的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
20.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol-1 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
5.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:
下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
2.草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
(4)结晶水合草酸(H2C2O4•2H2O)成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为:5H2C2O4+2MnO4-+6H+═2Mn2++8H2O+10CO2↑;列式计算该成品的纯度94.5%.
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
3.X、Y、Z三种金属及其化合物间可发生如下反应:
Y+ZCl2═Z+YCl2 X+ZCl2═Z+XCl2
Y+2HCl═YCl2+H2↑ X+HCl→不反应
则X、Y、Z三种金属活动性由强至弱的顺序是( )
Y+ZCl2═Z+YCl2 X+ZCl2═Z+XCl2
Y+2HCl═YCl2+H2↑ X+HCl→不反应
则X、Y、Z三种金属活动性由强至弱的顺序是( )
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
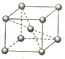 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.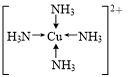 (写在方框内).
(写在方框内).
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.