题目内容
7.氧化还原反应在生产和生活中有着广泛的应用,请写出下列反应的离子方程式.(1)将去掉氧化膜的铝丝插入胆矾溶液中:2Al+3Cu2+═2Al3++3Cu.
(2)除去铁粉中混有的铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)除去氯化铁溶液中的氯化亚铁:2Fe2++Cl2═2Fe3++2Cl-.
(4)除去硫酸铁溶液中的硫酸亚铁:2Fe2++2H++H2O2═2Fe3++2H2O.
(5)用稀烧碱溶液吸收尾气中的氯气:Cl2+2OH-═Cl-+ClO-+H2O.
(6)硫化钠溶液久置在空气中变浑浊:2S2-+O2+2H2O═2S↓+4OH-.
分析 (1)Al与硫酸铜反应生成硫酸铝和Cu;
(2)Al与NaOH溶液反应,而Fe不能;
(3)氯气与氯化亚铁反应生成氯化铁;
(4)过氧化氢与亚铁离子反应可除杂,不引入新杂质;
(5)氯气与NaOH溶液反应可处理;
(6)硫离子被氧气氧化生成S.
解答 解:(1)Al与硫酸铜反应生成硫酸铝和Cu,离子反应为2Al+3Cu2+═2Al3++3Cu,故答案为:2Al+3Cu2+═2Al3++3Cu;
(2)Al与NaOH溶液反应,而Fe不能,离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)氯气与氯化亚铁反应生成氯化铁,离子反应为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(4)过氧化氢与亚铁离子反应可除杂,不引入新杂质,离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故答案为:2Fe2++2H++H2O2═2Fe3++2H2O;
(5)氯气与NaOH溶液反应可处理,离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(6)硫离子被氧气氧化生成S,离子反应为2S2-+O2+2H2O═2S↓+4OH-,故答案为:2S2-+O2+2H2O═2S↓+4OH-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
13.下列关于阿佛加德罗常数的说法正确的是( )
| A. | 0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 | |
| B. | 一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA | |
| C. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| D. | 1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
14.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1的FeCl3溶液中:HCO3-、K+、SO42-、Br- | |
| B. | 滴入酚酞试液显红色的溶液中:NH4+、SO42-、Fe2+、Cl- | |
| C. | 通入大量SO2的溶液中:Na+、Cl-、S2-、SO42- | |
| D. | pH=1的溶液中:Mg2+、Ca2+、NO3-、Ag+ |
2.草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
(4)结晶水合草酸(H2C2O4•2H2O)成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为:5H2C2O4+2MnO4-+6H+═2Mn2++8H2O+10CO2↑;列式计算该成品的纯度94.5%.
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
16.对于反应:3BrF3+5H2O=Br2+HBrO3+O2+9HF,下列说法正确的是( )
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
17.醋酸在日常生活和生产中的应用很广泛.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
①写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3;
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
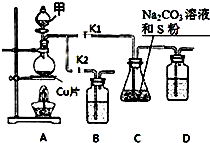 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.