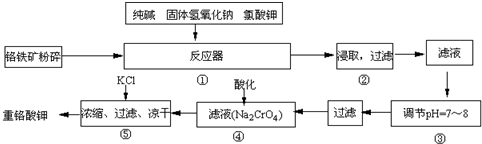
题目内容
8.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L.下列判断正确的是( )| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
分析 2min末该反应达到平衡,生成0.8molD,C的浓度为0.4mol/L,n(C)=0.4mol/L×2=0.8mol,由相同时间物质的量比之比等于化学计量数之比可知,x=2,则
3A(g)+B(g)?2C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.8 0.8
2min 1.8 0.6 0.8 0.8
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%、混合气体的质量随反应进行在不断变化来解答.
解答 解:2min末该反应达到平衡,生成0.8molD,C的浓度为0.4mol/L,n(C)=0.4mol/L×2=0.8mol,由相同时间物质的量比之比等于化学计量数之比可知,x=2,则
3A(g)+B(g)?2C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.8 0.8
2min 1.8 0.6 0.8 0.8
A.由上述分析可知,x=2,故A错误;
B.A的平均反应速率为$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/(L•min),故B错误;
C.B的转化率为$\frac{0.4}{1}$×100%=40%,故C错误;
D.ρ=$\frac{m}{V}$,V始终不变,D为固体,则混合气体的质量随反应进行在不断变化,可知若混合气体的密度不再改变时,该反应一定达到平衡状态,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意D为固体及平衡判定方法,题目难度不大.

| A. | 小于2:7 | B. | 等于2:7 | C. | 大于2:7 | D. | 无法肯定 |
| A. | 当4v(H2)=v(N2)时,反应达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})×{c}^{4}({H}_{2}O)}{c(S{O}_{2})×{c}^{2}(NO)×{c}^{4}({H}_{2})}$ |
| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③④ |
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 范德华力 |
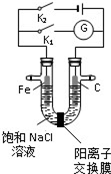
| A. | K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 | |
| B. | K1或 K2闭合,石墨棒周围溶液 pH 均升高 | |
| C. | K2闭合,铁棒上发生的反应为 2Cl--2e-═Cl2↑ | |
| D. | K2闭合,电路中通过 0.002NA个电子时,两极共产生 0.002mol 气体 |
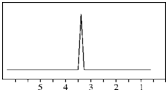 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)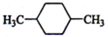 B、
B、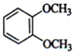 C、
C、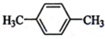 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3