题目内容
18.如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中,下列分析正确的是( )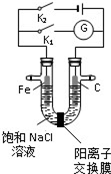
| A. | K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 | |
| B. | K1或 K2闭合,石墨棒周围溶液 pH 均升高 | |
| C. | K2闭合,铁棒上发生的反应为 2Cl--2e-═Cl2↑ | |
| D. | K2闭合,电路中通过 0.002NA个电子时,两极共产生 0.002mol 气体 |
分析 若闭合K1,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,碳棒与正极相连为阳极,据此判断.
解答 解:A.若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe-2e-=Fe2+,故A错误;
B.若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,所以石墨棒周围溶液pH逐渐升高;若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,碳棒与正极相连为阳极,反应为2Cl--2e-=Cl2↑,石墨棒周围溶液pH不变,故B错误;
C.K2闭合,Fe与负极相连为阴极,反应为2H++2e-=H2↑,故C错误;
D.K2闭合,Fe与负极相连为阴极,反应为2H++2e-=H2↑,碳棒与正极相连为阳极,反应为2Cl--2e-=Cl2↑,电路中通过0.002NA个电子时,阴极生成0.001mol氢气,阳极生成0.001mol氯气,两极共产生0.002mol气体,故D正确.
故选D.
点评 本题考查了原电池原理和电解池原理,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L.下列判断正确的是( )
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
9.1mol某烃最多能与2molHCl发生加成反应,生成的产物最多能与8mol Cl2发生取代反应,则该烃的化学式是( )
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
6.水玻璃溶液敞口放置空气中会变质,主要是因为与X反应生成Y,则X和Y分别是( )
| A. | CO2和H4SiO4 | B. | O2和SiO2 | C. | CO2和Na2CO3 | D. | H2和NaOH |
13.现有16.8g由Fe、Fe2O3、Al、Al2O3组成的混合物,将它完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96L.已知混合物中Fe、Fe2O3、Al、Al2O3的质量分数分别为16.7%、16.1%、38.1%、29.1%,欲使溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是( )
| A. | 800mL | B. | 300mL | C. | 600mL | D. | 900mL |
10.某温度下,CuSO4饱和溶液的质量分数为a%,取一定量的此饱和溶液,向其中加入m g无水CuSO4,在温度不变的情况下析出W g CuSO4•5H2O晶体,则原饱和溶液中溶质CuSO4的质量减少( )
| A. | m×a% | B. | W×a% | C. | (m+W)×a% | D. | (W-m)×a% |
7.下列物质属于纯净物的是( )
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
| A. | ①③⑤⑥ | B. | ③⑤⑥ | C. | ②④⑦ | D. | ③⑤ |
8.下列离子方程式书写正确的是( )
| A. | 在100ml 1mol•L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100ml 2mol•L-1的FeI2的溶液中通入标况下5.6L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O |
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.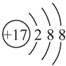 .
.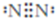 .
.