题目内容
17.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为1:1.
(2)上述反应中的氧化剂是As2S3,反应产生的气体可用NaOH吸收.
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-→2H3AsO4+3S+10NO2↑+2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为10mol.若将该反应设计成一原电池,则NO2应该在正极(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的碳反应,所产生的CO2的量a(选填编号).
a.小于0.5mol b.等于0.5mol
c.大于0.5mol d.无法确定.
分析 (1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根据方程式或化合价的变化判断;
(2)反应中As和Sn元素化合价发生变化,根据化合价的变化判断氧化剂和还原剂等概念;
(3)根据化合价的升降以及物质的量的情况来计算转移电子的量;NO3-发生还原反应生成二氧化氮,所以二氧化氮在正极附近逸出;
(4)根据化合价的变化计算电子转移的数目,进而结合反应的关系式可确定生成二氧化碳的物质的量.
解答 解:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1,故答案为:1:1;
(2)反应中As元素化合价降低,As2S3为氧化剂,H2S为酸性气体,可用NaOH溶液吸收,故答案为:As2S3;NaOH溶液;
(3)反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O中,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,则生成2mol H3AsO4,转移电子为2×2mol+3×2mol=10mol,NO3-发生还原反应生成二氧化氮,所以二氧化氮在正极附近逸出,故答案为:10mol;正极;
(4)反应的关系式为O2~4HNO3~CO2,
n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据电子守恒可知生成CO2的量是0.5mol,但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则生成的二氧化碳的物质的量少于0.5mol,
故答案为:a.
点评 本题综合考查氧化还原反应的计算和概念的理解,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的化学科学素养,难度不大,注意从元素化合价的角度识别相关概念、判断物质的性质.

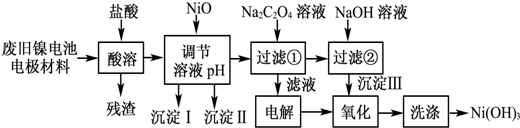
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
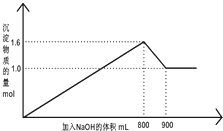 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③全部 |
①具有较低的熔、沸点
②不是电解质
③固体时是分子晶体
④都由分子构成
⑤液态时不导电.
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
| A. | CO2和H4SiO4 | B. | O2和SiO2 | C. | CO2和Na2CO3 | D. | H2和NaOH |
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
| A. | ①③⑤⑥ | B. | ③⑤⑥ | C. | ②④⑦ | D. | ③⑤ |