题目内容
1.某一溶液中含amol FeCl3和bmol CuCl2,向其中加入足量的铁粉,充分反应后,再过滤,残渣质量小于加入的铁粉质量,则a:b( )| A. | 小于2:7 | B. | 等于2:7 | C. | 大于2:7 | D. | 无法肯定 |
分析 在氯化铁和氯化铜的混合溶液中加入足量的铁粉,分别发生反应:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,残渣质量小于加入的铁粉质量,即所得固体残渣的质量比原铁粉的质量小,则消耗的铁的质量应大于生成的铜的质量,以此解答该题.
解答 解:设混合物中含有xmolFeCl3,ymol氯CuCl2,在FeCl3和CuCl2的混合溶液中加入过量的铁粉,
分别发生反应:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,
2 1 1 1 1
$\frac{1}{2}$x x y y y
由于充分反应后残渣质量小于加入的铁粉质量,则消耗的铁的质量应大于生成的铜的质量,
即:(0.5x+y)×56>64y,
x:y>8:28=2:7,
故选C.
点评 本题考查铁离子与亚铁离子转变、混合物的简单计算,注意把握铁与氯化铁和氯化铜反应的方程式的书写,根据质量关系结合方程式计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.已知NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
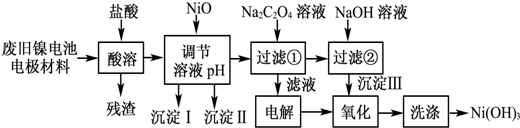
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
16.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
8.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L.下列判断正确的是( )
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
5.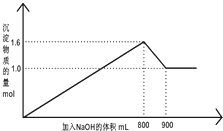 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
(4)加入NaOH 的溶液物质的量浓度为8mol/L.
 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
6.水玻璃溶液敞口放置空气中会变质,主要是因为与X反应生成Y,则X和Y分别是( )
| A. | CO2和H4SiO4 | B. | O2和SiO2 | C. | CO2和Na2CO3 | D. | H2和NaOH |