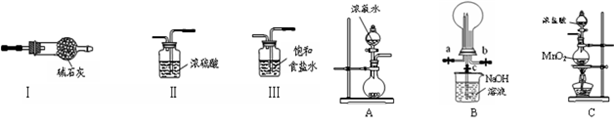
题目内容
3. (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)A、
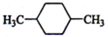 B、
B、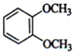 C、
C、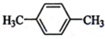 D、CH3CH2CH2CH3
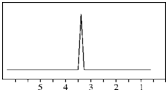
D、CH3CH2CH2CH3(2)化合物A的分子式是C2H4Br2,A的核磁共振氢谱图如图,则:A的结构简式为:Br-CH2-CH2-Br
(3)某烃的化学式为C4H8,其同分异构体的数目有6种(要考虑顺反异构)
(4)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O.则该有机物A的最简式为CH3O,A的红外光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,而A在核磁共振氢谱中出现两组峰,且其面积之比为2:1,则该有机物的简式为HO-CH2-CH2-OH.
分析 (1)核磁共振氢谱中给出的峰值(信号)有2个,说明有2种H原子,且峰的面积比为3:2的,即H原子个数为3:2;
(2)化合物A的分子式是C2H4Br2,A的核磁共振氢谱图如图,说明结构对称,含有1种H;
(3)C4H8可为烯烃和环烷烃;
(4)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O.可计算C、H的质量并确定O的质量,进而计算C、H、O的原子个数比,计算最简式,结合结构特点确定有机物结构简式.
解答 解:(1)核磁共振氢谱中给出的峰值(信号)有2个,说明有2种H原子,且峰的面积比为3:2的,即H原子个数为3:2,符合要求的有CD,A有2种H,但比值为3:4,B有3种H,故答案为:CD;
(2)化合物A的分子式是C2H4Br2,A的核磁共振氢谱图如图,说明结构对称,含有1种H,应为Br-CH2-CH2-Br,故答案为:Br-CH2-CH2-Br;
(3)C4H8且属于烯烃的有机物结构有:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,其中CH3CH=CHCH3存在顺反异构,共4种,另有环丁烷、甲基环丙烷,共6种,
故答案为:6;
(4)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O.可知n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,m(C)=1.2g,m(H)=0.3g,则m(O)=3.1g-1.2g-0.3g=1.6g,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,则N(C):N(H):N(O)=0.1:0.3:0.1=1:3:1,则A的最简式为CH3O,A的红外光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,而A在核磁共振氢谱中出现两组峰,且其面积之比为2:1,则该有机物的简式为HO-CH2-CH2-OH,
故答案为:CH3O;HO-CH2-CH2-OH.
点评 本题综合考查有机物的推断,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据有机物生成的二氧化碳和水的质量结合相对分子质量可判断有机物的分子式,注意有机物的结构特点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
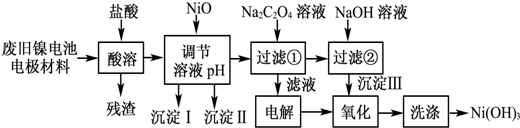
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸.
(4)写出“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(5)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.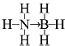 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).