题目内容
20.肼(N2H4)能与硫酸反应生成N2H6SO4,已知N2H6SO4的晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在( )| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 范德华力 |
分析 硫酸铵晶体中铵根离子和硫酸根离子之间存在离子键,铵根离子内部N和H之间存在共价键,离子晶体不存在分子间作用力.
解答 解:硫酸铵晶体中铵根离子和硫酸根离子之间存在离子键,铵根离子内部N和H之间存在共价键,硫酸铵晶体属于离子晶体,不存在分子间作用力,N2H6SO4的某晶体晶体类型与硫酸铵相同,所以该晶体中含有离子键、共价键和氮与氢之间的配位键、阳离子和阴离子,不存在分子间作用力,
故选D.
点评 本题考查了物质的结构,难度不大,侧重于不同晶体的化学键和分子间作用力的区别,注意离子晶体不存在分子间作用力.

练习册系列答案
相关题目
16.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
8.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L.下列判断正确的是( )
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
15.下列对应的表达方式错误的是( )
| A. | Cl-的结构示意图 | B. | 氯化氢分子的电子式: | ||
| C. | 碳-12原子${\;}_{5}^{12}C$ | D. | HClO的结构式H-O-Cl |
5.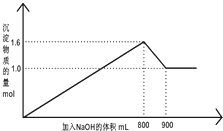 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
(4)加入NaOH 的溶液物质的量浓度为8mol/L.
 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:(1)加入NaOH 溶液900mL 时,溶液中的沉淀是Fe(OH)3,溶液中的溶质是NaCl、NaAlO2.(填化学式)
(2)加入NaOH 溶液800mL 至900mL 之间时,发生的离子反应方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)将混合溶液中各溶质的物质的量浓度填入下表:
| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
12.现有下列四种因素:①所含微粒数目;②微粒本身大小;③微粒间距离,其中对气体体积有显著影响的是( )
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③全部 |
9.1mol某烃最多能与2molHCl发生加成反应,生成的产物最多能与8mol Cl2发生取代反应,则该烃的化学式是( )
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
10.某温度下,CuSO4饱和溶液的质量分数为a%,取一定量的此饱和溶液,向其中加入m g无水CuSO4,在温度不变的情况下析出W g CuSO4•5H2O晶体,则原饱和溶液中溶质CuSO4的质量减少( )
| A. | m×a% | B. | W×a% | C. | (m+W)×a% | D. | (W-m)×a% |