题目内容
15.将Mg、Al、Zn三种金属混合物与足量的稀硫酸反应,得3.36L氢气(标准状况),则三种金属的物质的量之和可能是( )| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
分析 Mg、Zn与盐酸反应都表现为+2价,Al与盐酸反应表现+3价,可把Mg、Zn看成一种成分,Al看成另一种成分,则把该混合物转化成+2价的金属和+3价的金属组成的混合物,然后用极端法计算,假设全部是Mg(Zn),假设全是Al,计算Mg、Al物质的量,实际混合物的物质的量之和应介于二者之间.
解答 解:氢气的物质的量=$\frac{3.36L}{22.4L/mol}$=0.15ol,
假设全部是Mg或Zn,设它们的物质的量之和为xmol,产生的H2有如下关系:
Mg(Zn)~H2
1mol 1mol
x 0.15mol
所以1mol:1mol=xmol:0.125mol,解得:x=0.15
假设全是Al,设它的物质的量为ymol,产生的H2关系为:
2 Al~3H2
2mol 3mol
y 0.15mol
所以2mol:3mol=ymol:0.15mol,解得:y=0.1
于是以上两种情况的混合物,故混合物计算的物质的量之和应介于0.1ol~0.15mol之间,
选项中只有A符合,
故选A.
点评 本题考查混合物的计算,难度中等,注意根据化合价将三组分看做二组分,再采取极端法解答,极端法是化学计算中的一种技巧性解法,对于混合物范围计算比较适用,该方法的解题思路是假设只有混合物中的某一成份,通过计算得出两个极端值.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
6.在N2(g)+3H2(g)?2NH3(g);△H<0的反应中,下列叙述不正确的是( )
(1)加压,使正反应速率加快,逆反应速率减慢;平衡向正反应方向移动
(2)升高温度,使正反应速率变慢、逆反应速率加快,平衡向逆反应方向移动
(3)使用催化剂,既加快正、逆反应速率,又有利于平衡向正反应方向移动
(4)温度越低,单位时向内氨的产量越高
(5)增大反应物浓度,平衡向正反应方向移动,反应物的利用率一定提高.
(1)加压,使正反应速率加快,逆反应速率减慢;平衡向正反应方向移动
(2)升高温度,使正反应速率变慢、逆反应速率加快,平衡向逆反应方向移动
(3)使用催化剂,既加快正、逆反应速率,又有利于平衡向正反应方向移动
(4)温度越低,单位时向内氨的产量越高
(5)增大反应物浓度,平衡向正反应方向移动,反应物的利用率一定提高.
| A. | 只有(1)(2) | B. | 只有(1)(2)(3) | C. | 只有(4)(5) | D. | 全不正确 |
3.n滴水其质量为m g,则1滴水所含水分子的个数为(NA表示阿伏加德罗常数的值)( )
| A. | $\frac{m{N}_{A}}{18n}$ | B. | $\frac{18m{N}_{A}}{n}$ | C. | 18mnNA | D. | $\frac{n{N}_{A}}{18n}$ |
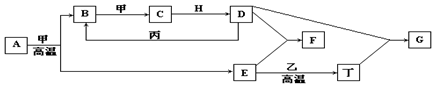
10. 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
4.已知醇之间发生反应:R-OH+H-OR′$→_{△}^{浓硫酸}$R-O-R′(醚)+H2O,由两种不同的醇反应得到某醚M为C5H11OC5H11,它代表了多少种物质( )
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
11.下列说法正确的是( )
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △H<0且△S<0的反应一定能自发发生 |
8.实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2CH2COO)2Fe].有关物质性质:
实验过程:
I.制备FeCO3:将0.10mol绿矾于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO)2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如下表:
pH过低使产率下降的原因是H+会与NH2CH2COOH反应;柠檬酸的作用还有bc(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化
c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2O2定量快速氧化.)
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO)2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如下表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
a.作反应终点指示剂 b.防止二价铁被氧化
c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2O2定量快速氧化.)
9.在同温同压下,A容器中盛有H2,B容器中盛有NH3,它们所含的原子总数相等,则两容器中气体的密度之比为( )
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 2:17 |