题目内容
8.实验室以绿矾(FeSO4•7H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2CH2COO)2Fe].有关物质性质:| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
I.制备FeCO3:将0.10mol绿矾于水中,加入少量铁粉,边搅拌边缓慢加入1.1mol•L-1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO)2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.

回答下列问题:
(1)实验I中:铁粉的作用是防止二价铁被氧化;生成沉淀的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(2)实验II中:
①装置B中试剂为饱和NaHCO3溶液.
②当C中空气排净后,应停止滴加盐酸,打开止水夹b,关闭止水夹a
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽.
④柠檬酸可调节pH,体系pH与产率的关系如下表:
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
a.作反应终点指示剂 b.防止二价铁被氧化
c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度.
⑥若产品的质量为m g,则产率为$\frac{m}{20.4}$.
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节):称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2O2定量快速氧化.)
分析 (1)二价铁具有较强的还原性,在制备碳酸亚铁的过程中,要防止二价铁被氧化,二价铁离子与碳酸氢根离子反应生成碳酸铁沉淀;
(2)①防止挥发的HCl干扰后面的实验,故需除去,可选用饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,故硬关闭止水夹b,打开止水夹a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒计算,产率=$\frac{实际产量}{理论产量}$;
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量.
解答 解:(1)二价铁具有较强的还原性,在制备碳酸亚铁的过程中,为了防止二价铁被氧化,需加入少量铁粉,绿矾的水溶液与NH4HCO3溶液反应的方程式为 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:防止二价铁被氧化;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)①由于稀盐酸与石灰质制备二氧化碳的过程中,HCl有挥发性,为了避免挥发出的HCl干扰后续试验,故需除去,可选用饱和NaHCO3溶液,
故答案为:饱和NaHCO3溶液;
②当C中空气排净后,应停止滴加盐酸,制备产物,此过程不需要二氧化碳,需要控制左侧的物质不能进入右侧的反应装置,故硬关闭止水夹b,打开止水夹a,故答案为:b;a;
③装置D中Ca(OH)2的作用是判断装置中控器是否排尽,若产生沉淀则需要继续除空气,以免对实验造成干扰,
故答案为:判断装置中控器是否排尽;
④pH过低使产率下降的原因是H+会与NH2CH2COOH中的氨基反应,柠檬酸有强酸性和还原性,作用还有促进FeCO3溶解,防止二价铁被氧化,故答案为:H+会与NH2CH2COOH反应;bc;
⑤由于甘氨酸亚铁易溶于水,难溶于乙醇,故乙醇的作用是降低甘氨酸亚铁在水中的溶解度,提高产率和纯度,
故答案为:降低甘氨酸亚铁在水中的溶解度,提高产率和纯度;
⑥根据原子守恒,绿矾中的铁元素为0.10mol,过程中NH4HCO3溶液过量,故根据铁原子守恒知理论上产生[(NH2 CH2COO)2 Fe0.10mol,其质量为20.4g,故产率=$\frac{实际产量}{理论产量}$=$\frac{m}{20.4}$,故答案为:$\frac{m}{20.4}$;
(3)测定产品中二价铁含量,称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次,可根据消耗的高锰酸钾的量计算二价铁的量,
故答案为:称取一定质量的产品溶于水中,加入适量H2SO4酸化,用KMnO4标准溶液滴定,记录消耗的体积,重复实验2-3次.
点评 本题考查实验制备方案,涉及化学反应基本原理、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,题目难度中等.

| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
| A. | 量筒 | B. | 玻璃棒 | C. | 试管 | D. | 锥形瓶 |
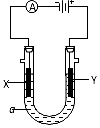 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: