题目内容
3.n滴水其质量为m g,则1滴水所含水分子的个数为(NA表示阿伏加德罗常数的值)( )| A. | $\frac{m{N}_{A}}{18n}$ | B. | $\frac{18m{N}_{A}}{n}$ | C. | 18mnNA | D. | $\frac{n{N}_{A}}{18n}$ |
分析 根据n=$\frac{m}{M}=\frac{N}{{N}_{A}}$计算相关物理量.
解答 解:n滴水水的物质的量为$\frac{mg}{18g/mol}$=$\frac{m}{18}$mol,
则n滴水的分子个数为$\frac{m{N}_{A}}{18}$,以1滴水所含水分子的个数为$\frac{m{N}_{A}}{18n}$,
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
11.与己二酸( )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )
 )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )| A. | 6 种 | B. | 7 种 | C. | 8 种 | D. | 9 种 |
8.在温度t1和t2下(t2>t1),卤素单质X2(g)和H2反应生成HX的平衡常数如下表:
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,得到的结论是( )
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
15.将Mg、Al、Zn三种金属混合物与足量的稀硫酸反应,得3.36L氢气(标准状况),则三种金属的物质的量之和可能是( )
| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
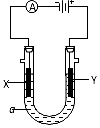 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: