题目内容
10.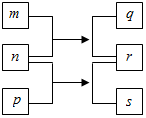 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
分析 n、p、q是由这些元素组成的二元化合物,p是一种淡黄色粉末,p为Na2O2,q的水溶液可在玻璃器皿上蚀刻标记,q为HF,0.01mol•L-1s溶液的pH为12,s为NaOH,m是元素Y的单质,结合图中转化可知,Y为F,m为F2,则n为H2O,r为O2,短周期元素W、X、Y、Z的原子序数依次增加,则W为H,X为O,Z为Na,以此来解答.
解答 解:n、p、q是由这些元素组成的二元化合物,p是一种淡黄色粉末,p为Na2O2,q的水溶液可在玻璃器皿上蚀刻标记,q为HF,0.01mol•L-1s溶液的pH为12,s为NaOH,m是元素Y的单质,结合图中转化可知,Y为F,m为F2,则n为H2O,r为O2,短周期元素W、X、Y、Z的原子序数依次增加,则W为H,X为O,Z为Na,
A.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:X>Y>Z,故A正确;
B.F的非金属性大于O,氧化性:r<m,故B错误;
C.HF只含共价键,Na2O2含离子键和共价键,故C错误;
D.等体积等浓度的q溶液与s溶液反应后,生成NaF,水解显碱性,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律及盐类水解、化学键的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.在含有I-且能使石蕊试液变红的溶液中能大量共存的离子组为( )
| A. | Fe3+、Na+、Br- | B. | NH4+、Na+、AlO2- | C. | Ba2+、Al3+、Cl- | D. | K+、MnO4-、NO3- |
5.某有机物的分子式为C5H10O3,其中同时含有-COOH和-OH的有机物有( )
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
15.将Mg、Al、Zn三种金属混合物与足量的稀硫酸反应,得3.36L氢气(标准状况),则三种金属的物质的量之和可能是( )
| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
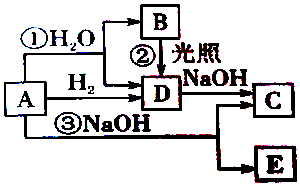
 ,其阴阳离子个数比为1:2.
,其阴阳离子个数比为1:2.