题目内容
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )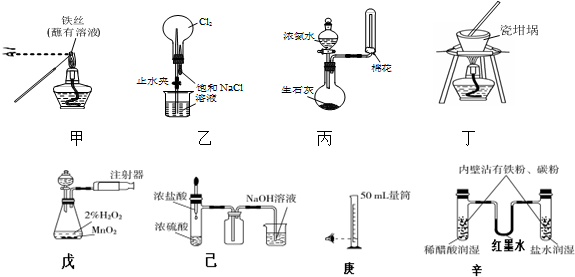
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
分析 ①观察K的焰色反应应透过蓝色的钴玻璃;
②浓氨水与生石灰混合可生成氨气,氨气的密度比空气的密度小;
③氯气不易溶于食盐水;
④瓷坩埚中的二氧化硅与NaOH反应;
⑤根据一定时间内生成气体体积测定反应速率;
⑥尾气处理装置要防止倒吸;
⑦量取溶液时,选取量筒规格要稍微大于或等于量取溶液体积;
⑧强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀.
解答 解:①观察K的焰色反应应透过蓝色的钴玻璃,由图可知,缺少蓝色的钴玻璃,故①错误;
②浓氨水与生石灰混合可生成氨气,氨气的密度比空气的密度小,则图中固液反应不加热装置及向下排空气法均合理,故②正确;
③氯气不易溶于食盐水,则图中装置不能形成喷泉实验,故③错误;
④瓷坩埚中的二氧化硅与NaOH反应,仪器选择不合理,应使用铁坩埚,故④错误;
⑤根据一定时间内生成气体体积测定反应速率,因为缺少秒表而无法记录时间,则无法测定反应速率,故⑤错误;
⑥HCl极易溶于NaOH溶液,所以尾气处理装置中导气管不能伸入液面下,否则易产生倒吸,故⑥错误;
⑦量取溶液时,选取量筒规格要稍微大于或等于量取溶液体积,所以量取8.5mL的稀硫酸应该用10mL量筒,故⑦错误;
⑧强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,所以U形管中左端红墨水下降、右端红墨水上升,所以能实现实验目的,故⑧正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及焰色反应、气体的制备及收集、物质的性质、量筒的选取方法等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意装置的作用及实验的评价性分析,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
5.下列说法正确的是( )
| A. | 碳酸的酸性比硅酸强 | |
| B. | 136C表示该元素的相对原子质量近似为13,核电荷数为6 | |
| C. | 共价键必然存在于共价化合物中 | |
| D. | X、Y+、Z-三种粒子的电子层结构相同,则其质子数一定不相等 |
6.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2的电子式 | B. | Cl-的结构示意图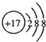 | ||
| C. | MgCl2的电子式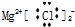 | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
3.在高温、高压和有催化剂的恒容密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g).下列叙述正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
7.根据如图,下列判断中正确的是( )
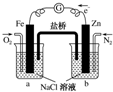

| A. | 烧杯a中的溶液pH降低 | B. | 烧杯b中发生的反应为2H++2e-═H2↑ | ||
| C. | 烧杯a中发生的反应为Fe-2e-═Fe2+ | D. | 烧杯b中发生氧化反应 |
4.在密闭容器中进行X2(g)+2Y2(g)?Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.9mol/L |
 化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.
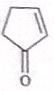
化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用. (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题: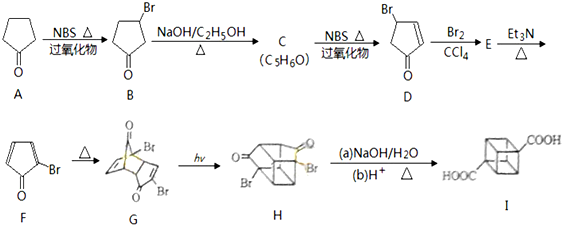
 ,E的结构简式为
,E的结构简式为 .
.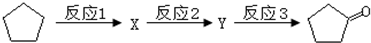
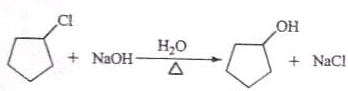 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.