题目内容
3.在高温、高压和有催化剂的恒容密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g).下列叙述正确的是( )| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
分析 对于可逆反应,反应物不可能全部转化为生成物,在反应中,加入催化剂、增大反应物浓度都可增大反应速率,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此解答.
解答 解:A.降温,化学反应速率减慢,故A错误;
B.加入催化剂,降低反应的活化能,增大活化分子的百分数,可增大反应速率,故B正确;
C.该反应为可逆反应,反应物不可能全部转化为生成物,故C错误;
D.达到平衡状态时,正逆反应速率相等,各物质的浓度不变但不一定相等,故D错误;
故选B.
点评 本题考查化学反应速率的影响以及化学平衡状态的判断等问题,为高考常见题型和高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握可逆反应的特点,难度不大.

练习册系列答案
相关题目
13.为了回收含有Ag+的废水中的贵重金属,可以向其中加入( )
| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
14.某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )
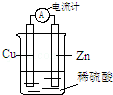

| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
11.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
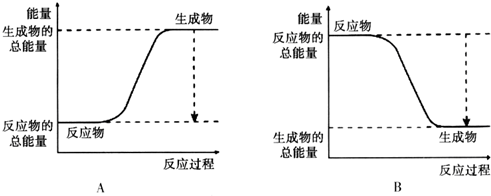
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.
(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
在理论上1molO2充分反应生成水放出热量(填吸收或放出)484kJ.
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.

(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
18.下列元素中,最高正化合价数值最大的是( )
| A. | Cl | B. | F | C. | C | D. | Na |
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
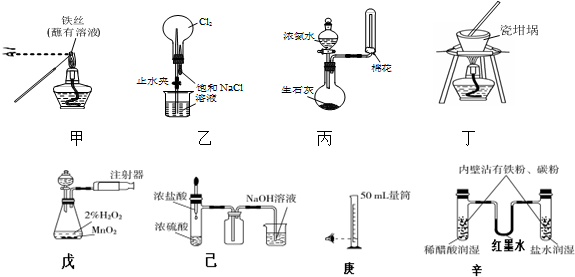
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.

①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
12.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
4.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、SiO${\;}_{3}^{2-}$.现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |