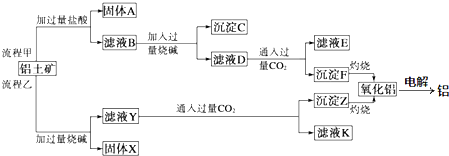
题目内容
16.硫化氢在科研、生活及化学工业中均有重要应用.(1)已知:H2S电离常数:K1=1.3×10-7,K2=7.0×10 -15,在废水处理领域中,H2S能使某些金属离子生成难溶硫化物而除去.250C时,0.1mol.L-1H2S溶液pH为(取近似整数)4;向含有0.020mol.L-lMn2+的废水中通入一定量H2S气体,调节溶液的pH=5,当HS-浓度为1.0×10-4mol•L一1时,Mn2+开始沉淀,则MnS的溶度积为2.8×10-13.
(2)工业上采用高温分解H2S制取氢气,在膜反应器中分离出H2.其反应为
2H2S(g)?2H2 (g)+S2 (g)△H1
已知:H2S(g)?H2(g)+S(g)△H2 2S(g)?S2 (g)△H3
则△H1=(用含△H2、△H3式子表示)
(3)在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2s起始浓度均为c mol•L-1测定H2S的转化率,结果如图1所示.图中a曲线表示H2S的平衡转化率与温度的关系,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.由图可知:2H2 S(g)?2H2 (g)+S2 (g)△H1>0(填“>”、“<”或
“=”);在985℃时,该反应经过时间t s达到平衡状态,反应速率v(H2)为$\frac{0.4c}{t}$,反应的平衡常数K为$\frac{0.8c}{9}$;H2S分解随温度升高,曲线b向曲线a逼近的原因是反应速率加快,达到平衡所需时间缩短.
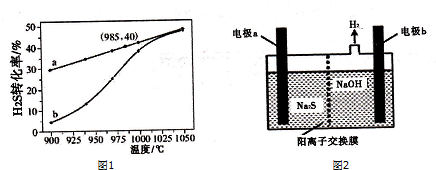
(4)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入如图2所示电解池中进行电解,在阳极区可生成Sn2-.试写出生成Sn2-的反应方程式(n-1)S+S2-═Sn2-.
分析 (1)根据Ka表达式结合电离平衡常数进行计算;当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合此时的pH,以及Ksp=c(Mn2+)•c(S2-)进行计算;
(2)已知:H2S(g)?H2(g)+S(g)△H2 2S(g)?S2 (g)△H3,利用盖斯定律来计算2H2S(g)?2H2 (g)+S2 (g)的△H1;
(3)根据温度升高,转化率增大,可知平衡正移,据此分析;根据转化率求出反应的量,再求反应速率;根据温度对速率的影响分析;
(4)阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S,根据电解原理来回答.
解答 解:(1)已知:H2S电离常数:K1=1.3×10-7,250C时,0.1mol.L-1H2S溶液中,设氢离子浓度是x,根据H2S?2H++HS-,则:$\frac{{x}^{2}}{0.1}$=1.3×10-7,解得x=$\sqrt{1.3}$×10-4,所以pH≈4,当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=5,H2S电离常数:K2=7.0×10-15,当HS-浓度为1.0×10-4mol•L-1时,c(S2-)=7×10-12mol•L-1,
所以Ksp=c(Mn2+)•c(S2-)=7×10-12mol•L-1×0.020mol.L-1=2.8×10-13,故答案为:4;2.8×10-13;
(2)已知:①H2S(g)?H2(g)+S(g)△H2
②2S(g)?S2 (g)△H3
反应:2H2S(g)?2H2 (g)+S2 (g)可以根据①×2+②得到,所以△H1=2△H2+△H3,故答案为:△H1=2△H2+△H3;
(3)由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,v=$\frac{△c}{△t}$=$\frac{0.4c}{t}$mol•L-1•min-1;以H2S起始浓度均为cmol•L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
2H2S(g)?2H2(g)+S2(g),
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡0.6c 0.4c 0.2c
K=$\frac{0.2c×(0.4c)^{2}}{(0.6c)^{2}}$=$\frac{0.8c}{9}$;随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:>;$\frac{0.4c}{t}$;$\frac{0.8c}{9}$;温度升高,反应速率加快,达到平衡所需时间缩短.
(4)电解过程中阳极区发生如下反应:S2--2e-═S,溶液中发生反应(n-1)S+S2-═Sn2-,故答案为:(n-1)S+S2-═Sn2-.
点评 本题考查了化学平衡及其影响,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生分析能力及化学计算能力.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案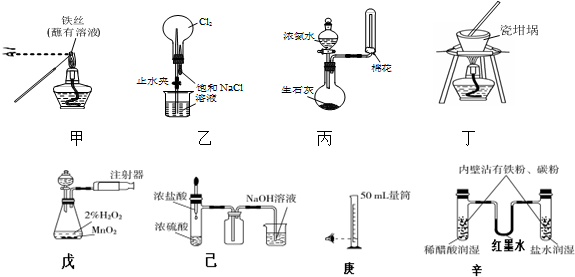
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
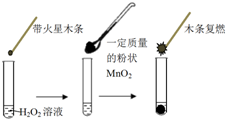 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验不能(填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.
| A. | 次氯酸 | B. | 活性炭 | C. | 二氧化碳 | D. | 二氧化硫 |