题目内容
10. 化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.
化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中$\frac{1}{3}$的Cu以Cu+形式存在.基态Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 .
(2)屠呦呦因在抗疟药--青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人.青蒿素的结构简式如图所示,其组成元素的电负性由大到小的顺序为O>C>H.其中碳原子的杂化方式为sp2、sp3.
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1mol NH4BF4中含有2mol配位键.
(4)安全气囊的设计原理为6NaN3+FeIO3$\frac{\underline{\;撞击\;}}{\;}$Na2O+2Fe+9N2↑.已知等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子CO2、CNO-(写化学式).
分析 (1)Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
(2)青蒿素的组成元素有C、H、H,非金属性越强电负性越大;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子;
(3)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,据此计算;
(4)原子总数相同、价电子总数相同的分子或离子互为等电子体.
解答 解:(1)Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,
故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)青蒿素的组成元素有C、H、H,非金属性越强电负性越大,故电负性O>C>H;分子中酯基中C原子为形成3个σ键、其它碳原子形成4个σ键,均没有孤对电子,碳原子的杂化方式为 sp2、sp3,
故答案为:O>C>H;sp2、sp3;
(3)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键.
故答案为:2;
(4)与N3-互为等电子体的分子或离子为N2O、CO2、CNO-或CNS-、NO2+等,故答案为:CO2、CNO-.
点评 本题考查了物质结构和性质,涉及核外电子排布式、电负性、原子杂化方式的判断、配位键、等电子体等知识点,这些知识点都是考试高频点,根据配位键的概念、价层电子对互斥理论等知识点来分析解答,题目难度中等.

练习册系列答案
相关题目
20.下列生活中的一些现象发生了化学变化的是 ( )
| A. | 食物发霉 | B. | 冰雪融化 | C. | 铜像生锈 | D. | 聚沙成塔 |
18.下列元素中,最高正化合价数值最大的是( )
| A. | Cl | B. | F | C. | C | D. | Na |
5.下列有关物质分类或归纳的说法中,正确的是( )
| A. | 蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体 | |
| B. | 聚乙烯、聚氯乙烯,纤维素都属于合成高分子 | |
| C. | 分馏、干馏,裂化都是化学变化 | |
| D. | 石蜡油分解产物可使溴水和酸性高锰酸钾溶液褪色 |
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
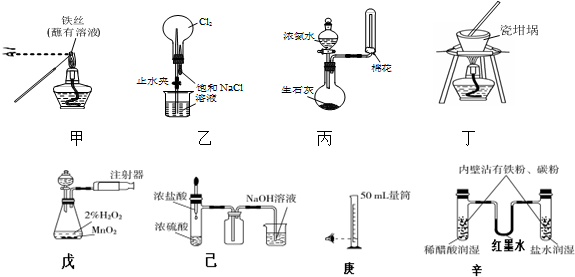
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.

①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
11.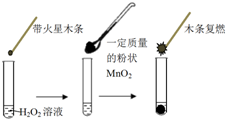 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验不能(填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
由此得出的结论是在一定质量范围内,MnO2质量越大,反应速率越快,原因是固体质量越大,其表面积也越大,故反应速率加快,催化效果更好.
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
结论是Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好,实验Ⅲ的目的是对比实验,证明Cl-对H2O2的分解没有催化作用.
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验不能(填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
 ;②二氧化碳
;②二氧化碳 .③氯化镁的形成过程:
.③氯化镁的形成过程: ;④次氯酸的形成过程:
;④次氯酸的形成过程: .
.