题目内容
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
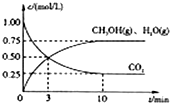
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如图所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该条件下CO2的转化率为
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度B.恒容时充入氮气 C.将水蒸气从体系中分离D.用更有效的催化剂.
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)根据三段式计算出反应混合物各组分的浓度变化量、平衡时的浓度,根据v=
计算出v(H2);
(2)根据转化率的定义计算平衡时二氧化碳的转化率;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动分析;
| △c |
| △t |
(2)根据转化率的定义计算平衡时二氧化碳的转化率;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动分析;
解答:
解:(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,反应方程式为
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
根据三段式计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L):1 3.25 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 1 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225mol/(L.min),故答案为:0.225mol/(L.min);
(2)平衡时二氧化碳的转化率为
×100%=75%,故答案为:75%;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动:
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入氮气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.用更有效的催化剂,平衡不移动,故D错误;
故答案为:C;
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),根据三段式计算
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)开始(mol/L):1 3.25 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 1 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
(2)平衡时二氧化碳的转化率为
| 0.75mol/L |
| 1mol/L |
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动:
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入氮气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.用更有效的催化剂,平衡不移动,故D错误;
故答案为:C;
点评:本题考查较为综合,涉及反应速率、平衡移动等知识,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下: 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸. 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.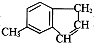 )是一种医药合成中间体,某同学设计它的合成路线如下:
)是一种医药合成中间体,某同学设计它的合成路线如下: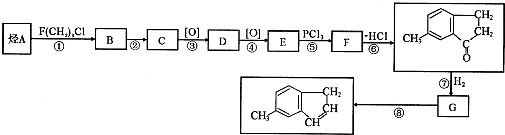
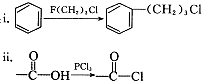
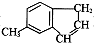 )的说法正确的是
)的说法正确的是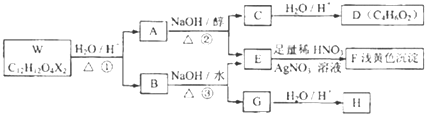

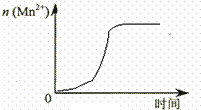 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: