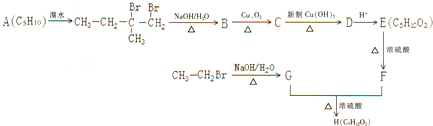
题目内容
 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H 2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
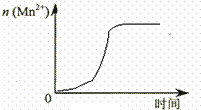
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图所示.为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用.
①请你填写表中空白帮助该小组同学完成实验方案.
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | t3 | |
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为
考点:探究影响化学反应速率的因素,原电池和电解池的工作原理
专题:实验设计题
分析:(1)探究KMnO4浓度对反应速率的影响,则必须保证其他影响反应速率的因素是相同的;如果研究温度对化学反应速率的影响,则必须保证其他影响反应速率的因素是相同的,据此分析;
(2)①作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
②若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
(3)原电池的正极发生还原反应,根据KMnO4 溶液和H 2C2O4 溶液的反应来分析正极反应.
(2)①作对比实验时,除了加入MnSO4不同外,其它量完全相同,据此进行解答;
②若反应加快,说明Mn2+是催化剂,反应过程中溶液褪色时间减少.
(3)原电池的正极发生还原反应,根据KMnO4 溶液和H 2C2O4 溶液的反应来分析正极反应.
解答:
解:(1)探究KMnO4浓度对反应速率的影响,则必须保证其他影响反应速率的因素是相同的,而由实验1可知,H2O、KMnO4溶液和稀硫酸的体积和为7.0mL,由于须保证稀硫酸的浓度相同,故n=2.0mL,则m=2.5mL;
如果研究温度对化学反应速率的影响,则必须保证除温度外,其他影响反应速率的因素是相同的,故要将实验4和实验1做比较,
故答案为:2.5;2.0;1;
(2)①与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,故答案为:MnSO4;
②若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,故答案为:与实验1比较,溶液褪色所需时间短.
(3)KMnO4 溶液和H 2C2O4 溶液的反应可知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,正极上MnO4-放电生成Mn2+,根据“列物质、标得失、看环境、配守恒”的方法,由于是酸性环境,故正极反应为:MnO4-+8H++5e-=Mn2++4H2O,故答案为:MnO4-+8H++5e-=Mn2++4H2O.
如果研究温度对化学反应速率的影响,则必须保证除温度外,其他影响反应速率的因素是相同的,故要将实验4和实验1做比较,
故答案为:2.5;2.0;1;
(2)①与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,故答案为:MnSO4;
②若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,故答案为:与实验1比较,溶液褪色所需时间短.
(3)KMnO4 溶液和H 2C2O4 溶液的反应可知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,正极上MnO4-放电生成Mn2+,根据“列物质、标得失、看环境、配守恒”的方法,由于是酸性环境,故正极反应为:MnO4-+8H++5e-=Mn2++4H2O,故答案为:MnO4-+8H++5e-=Mn2++4H2O.
点评:本题主要结合实验考查了影响化学反应速率的因素,题目难度不大,注意掌握温度、催化剂对化学反应速率的影响,在用对照试验来探究外界条件对反应速率的影响时,必须保证其他影响反应速率的条件一致.

练习册系列答案
相关题目
某种药物主要成分X的分子结构如图所示: 关于有机物X的说法中,不正确的是( )
关于有机物X的说法中,不正确的是( )
 关于有机物X的说法中,不正确的是( )
关于有机物X的说法中,不正确的是( )| A、X 难溶于水,易溶于有机溶剂 |
| B、X 能跟溴水发生加成反应 |
| C、X 能使酸性高锰酸钾溶液褪色 |
| D、X 的水解产物能发生消去反应 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Al3+、Na+、Cl-、SO42- |
在下列溶液中,Cl-物质的量浓度相同的是( )
| A、1L 0.2 mol/L A1C13溶液 |
| B、100ml 0.3 mol/L MgCl2溶液 |
| C、0.5L 0.1 mol/L NaCl溶液 |
| D、1L 0.3 mol/L HC1溶液 |
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
| C、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| D、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
某500mL溶液中含0.2molFe2+、0.4molFe3+,加入0.4molFe,待反应完全后,溶液中亚铁离子的物质的量浓度为( )
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.