题目内容
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下:(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度.
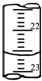
(1)滴定:如图表示某次滴定时50mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中.
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:Ⅰ、操作(1)中酸式滴定管加入标准的盐酸溶液前应用标准的盐酸溶液润洗;
操作(3)中眼睛应注视锥形瓶中溶液颜色变化;
Ⅱ、(1)根据滴定管的结构以及测量体积的原理来分析;
(2)先考虑数据的合理性,然后求体积的平均值,然后根据c(待测)=
计算;
(3)根据c(待测)=
分析误差;
Ⅲ、醋酸过量,为相同物质的量浓度醋酸和醋酸钠的混合溶液,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度.
操作(3)中眼睛应注视锥形瓶中溶液颜色变化;
Ⅱ、(1)根据滴定管的结构以及测量体积的原理来分析;
(2)先考虑数据的合理性,然后求体积的平均值,然后根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(3)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
Ⅲ、醋酸过量,为相同物质的量浓度醋酸和醋酸钠的混合溶液,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度.
解答:
解:Ⅰ、操作(1)中酸式滴定管加入标准的盐酸溶液前应用标准的盐酸溶液润洗,故错误;
操作(3)中眼睛应注视锥形瓶中溶液颜色变化,故错误;
故答案为:(1)(3);
Ⅱ、(1)滴定前读数为0.30mL,滴定后读数为24.90mL,消耗溶液的体积为24.60mL,故答案为:0.30mL,24.90mL,24.60mL;
(2)求出第1组、第2组、第3组消耗的盐酸标准液的体积为:
mL=24.60mL,c(待测)=
mol/L=0.0984mol/L,故答案为:0.0984mol/L;
(3)a.锥形瓶水洗后直接装待测液,消耗的标准液体积无影响,测定结果无影响,故答案为:无影响;
b、滴定管读数时,若滴定前仰视,滴定后俯视,导致V(标准)偏小,据c(待测)=
分析,导致c(待测)偏小,故答案为:偏低;
c.酸式滴定管尖嘴部分有气泡,滴定后消失,消耗的标准液体积偏大,测定结果偏高,故答案为:偏高;
Ⅲ、醋酸过量,为相同物质的量浓度醋酸和醋酸钠的混合溶液,若醋酸的电离程度与醋酸根的水解程度相同时,即可以认为醋酸不电离醋酸根不水解,则有c(CH3COO-)=c(Na+)=c(CH3COOH),现溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+)c(CH3COOH),
氢离子和氢氧根离子浓度都很小,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-).
操作(3)中眼睛应注视锥形瓶中溶液颜色变化,故错误;
故答案为:(1)(3);
Ⅱ、(1)滴定前读数为0.30mL,滴定后读数为24.90mL,消耗溶液的体积为24.60mL,故答案为:0.30mL,24.90mL,24.60mL;
(2)求出第1组、第2组、第3组消耗的盐酸标准液的体积为:
| 24.58+24.60+24.62 |
| 3 |
| 24.60×0.1000 |
| 25.00 |
(3)a.锥形瓶水洗后直接装待测液,消耗的标准液体积无影响,测定结果无影响,故答案为:无影响;
b、滴定管读数时,若滴定前仰视,滴定后俯视,导致V(标准)偏小,据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
c.酸式滴定管尖嘴部分有气泡,滴定后消失,消耗的标准液体积偏大,测定结果偏高,故答案为:偏高;
Ⅲ、醋酸过量,为相同物质的量浓度醋酸和醋酸钠的混合溶液,若醋酸的电离程度与醋酸根的水解程度相同时,即可以认为醋酸不电离醋酸根不水解,则有c(CH3COO-)=c(Na+)=c(CH3COOH),现溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+)c(CH3COOH),
氢离子和氢氧根离子浓度都很小,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-).
点评:本题主要考查了中和滴定操作、化学计算以及注意事项、溶液中离子浓度大小比较,难度中等,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、15g乙烷所含极性共价键的数目为3NA |
| B、0.1mol 甲基含有的质子数6.02NA |
| C、常温下,100mL0.1mol/L醋酸溶液中含醋酸分子为0.01NA |
| D、0.5mol乙醇完全燃烧时,转移的电子数为3NA |
下列有关硫的叙述中,不正确的是( )
| A、粘附在试管壁上的硫可用二硫化碳清洗 |
| B、S2和S8是同素异形体 |
| C、硫在自然界中主要以化合态形式存在 |
| D、硫粉和铜粉混合共热生成黑色的CuS |
以Mg、MgO、Mg(OH)2、MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取M可有多种方法,其中运用复分解反应的( )
| A、二种 | B、三种 | C、四种 | D、五种 |
20℃,已知2g氢气点燃后生成水放热235kJ,下列热化学方程式正确的是( )
A、H2(g)+
| ||
| B、H2(g)+O2(g)=2H2O(1)△H=-235kJ.mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+O2(g)=H2O(1)△H=-470kJ.mol-1 |
常温下能盛放在铁制容器中的物质是( )
| A、浓盐酸 | B、浓硝酸 |
| C、硫酸铜溶液 | D、稀硫酸 |
某种药物主要成分X的分子结构如图所示: 关于有机物X的说法中,不正确的是( )
关于有机物X的说法中,不正确的是( )
 关于有机物X的说法中,不正确的是( )
关于有机物X的说法中,不正确的是( )| A、X 难溶于水,易溶于有机溶剂 |
| B、X 能跟溴水发生加成反应 |
| C、X 能使酸性高锰酸钾溶液褪色 |
| D、X 的水解产物能发生消去反应 |
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.