题目内容
2.写出下列物质的电子式:KCl
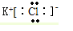
CO2

Cl2

NaOH

CH4

O2
 .
.
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
解答 解:KCl为离子化合物,由钾离子与氯离子构成,电子式为: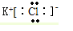 ,故答案为:
,故答案为: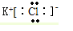 ;
;
CO2为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;Cl2的电子式为: ,故答案为:
,故答案为: ;
;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子,NaOH的电子式为: ,故答案为:
,故答案为: ;
;
CH4 分子中,碳原子与4个氢原子分别共用一对电子,形成4个C-H键碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
因此O2分子中有一个σ键和两个л键,其电子式可写 ,故答案为:
,故答案为: ;
;
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
13.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
10.实验室发生下列反应时,不用加入浓硫酸的是( )
| A. | 由液溴和苯制取溴苯 | B. | 用乙酸和乙醇制备乙酸乙酯 | ||
| C. | 由苯制取硝基苯 | D. | 由乙醇制乙烯 |
14.亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是( )
| A. | 亚硝酸钠外观与食盐相似 | |
| B. | 亚硝酸钠和食盐一样也具有咸味 | |
| C. | 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 | |
| D. | 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 |
10.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X、Y、Z三种元素的单质中,Z单质的氧化性最强 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2、CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
 向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.
向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.