题目内容
7.在氟、氯、溴、碘四种元素的氢化物中最不稳定的是HI(写化学式).分析 元素周期表中,同一主族元素从上到下,非金属性逐渐减弱,与氢气化合越来越难,形成的氢化物稳定性逐渐减弱,据此进行解答.
解答 解:氟、氯、溴、碘位于同一主族,周期表中同一主族元素从上到下,元素的非金属性逐渐减弱,与氢气化合越来越难,对应氢化物稳定性逐渐减弱,所以最不稳定的是HI,
故答案为:HI.
点评 本题考查了非金属元素在周期表中性质递变规律,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表之间的关系.

练习册系列答案
相关题目
17.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | Y的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X | |
| C. | Y、R形成化合物的化合物YR2能使KMnO4溶液褪色 | |
| D. | X、Z可形成化合物XZ3,且该化合物属离子化合物 |
18.下列物质中,既含有离子键,又含有非极性键的是( )
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
15.下列关于化学反应速率说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率0.8 mol/(L•s)是指1 s时某物质的浓度为0.8 mol/L | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L的KI溶液:NH4+、H+、SO42-、NO3- | |
| B. | 某澄清透明的溶液:Fe3+、Mg2+、SO42-、Cl- | |
| C. | 0.1mol/LNaClO溶液:NH4+、Fe2+、SO42-、NO3- | |
| D. | 0.1mol/L的氨水:Cu2+、K+、Cl-、NO3- |
19.下列固体投入水中,有气体产生的是( )
| A. | Na2O2 | B. | Na2O | C. | NaHCO3 | D. | Na2CO3 |
15.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,最易失电子的元素是K,非金属性最强的元素是F;
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;-(填写化学式)
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为

(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;-(填写化学式)
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl.
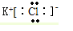




 .
.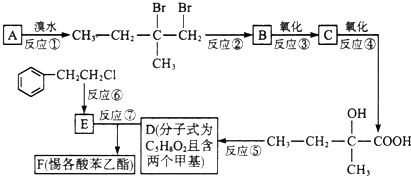
 ;F的结构简式为
;F的结构简式为 .
.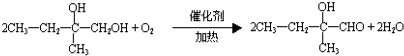 .
.