题目内容
11. 向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.
向100mL 3mol/L NaOH溶液中缓慢通入一定量的CO2,充分反应后,测得溶液的pH>7.(1)若此时溶液的溶质是单一成分,则其可能是Na2CO3或NaHCO3;如果是多种成分,则其可能是NaOH和Na2CO3或Na2CO3和NaHCO3.
(2)在上述所得溶液中,缓慢逐滴滴加1mol/L的盐酸,所得气体的体积(不考虑溶解于水)与所加盐酸的体积的关系如图所示.
①写出OA段发生反应的离子方程式:OH-+H+═H2O、CO32-+H+═HCO3-.
②产生的CO2在标准状况下的体积为2240mL(写出计算过程).
分析 (1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性;如果是多种成分,可能是二者混合物,也可能NaOH有剩余;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物.
②根据AB段消耗氯化氢溶液的体积、结合方程式计算生成二氧化碳的体积;
解答 解:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是Na2CO3或NaHCO3,如果是多种成分,若1<$\frac{n(NaOH)}{n(C{O}_{2})}$<2,溶质是NaHCO3、Na2CO3.若$\frac{n(NaOH)}{n(C{O}_{2})}$>2,溶质是Na2CO3、NaOH,
故答案为:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-,
故答案为:OH-+H+═H2O、CO32-+H+═HCO3-;
②AB段消耗HCl为0.1L×1mol/L=0.1mol,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
故答案为:2240mL;
点评 本题考查混合物的计算,题目难度中等,关键是根据图象分析各阶段发生的反应,注意计算过程中守恒思想的应用.

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 |
| A. | Na2O2 | B. | Na2O | C. | NaHCO3 | D. | Na2CO3 |
| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ③④⑤⑦⑧ | D. | ④⑦⑧ |
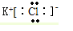

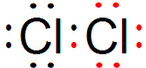

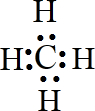
 .
.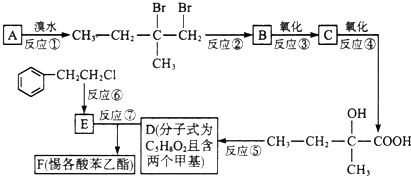
 ;F的结构简式为
;F的结构简式为 .
.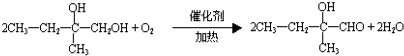 .
.