题目内容
13.下列叙述正确的是( )| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到金属的单质 | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能生成H+的化合物是酸 |
分析 A、还原能力的强弱和失电子的难易有关和失电子的数目无关;
B、金属阳离子被还原后,化合价降低,不一定是单质状态;
C.过氧化钠与盐酸反应:2Na2O2+4HCl═4NaCl+O2↑+2H2O,过氧化钠不是碱性氧化物;
D.水溶液中电离出来的阳离子全部是H+的化合物是酸.
解答 解:A、还原能力的强弱和失电子的难易有关而和失电子的数目无关,如金属钠和金属铁的还原能力是金属钠强于金属铁,故A错误;
B、金属阳离子铁离子被还原后,化合价降低,可以生成单质铁还可以生成亚铁盐,故B错误;
C.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物,过氧化钠与盐酸反应:2Na2O2+4HCl═4NaCl+O2↑+2H2O,过氧化钠不是碱性氧化物,故C正确;
D.电离时生成的阳离子全部是氢离子的化合物是酸,但有氢离子生成并不一定是酸,如NaHSO4,故D错误;
故选C.
点评 本题考查了反应类型的分析、氧化还原反应、物质分类方法、主要是概念实质理解,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.下列各图所表示的“一个反应过程”符合放热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下列化学反应属复分解反应的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 |
8.下列关于混合物、强电解质、弱电解质和非电解质的组合正确的是( )
| 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氨水 | H2SO4 | CH3COOH | 干冰 |
| B | 盐酸 | 氢氧化钠 | H2SO4 | SO2 |
| C | 纯碱 | BaSO4 | H2S | 空气 |
| D | 氢氧化钠溶液 | 石灰石 | 熔融NaCl | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
18.下列物质中,既含有离子键,又含有非极性键的是( )
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
3.有8种物质:①甲烷;②苯;③聚乙烯;④2-丁炔;⑤乙醇;⑥邻二甲苯;⑦环己烯;⑧乙醛.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑧ | C. | ③④⑤⑦⑧ | D. | ④⑦⑧ |
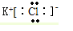




 .
.