题目内容
14.已知: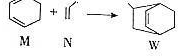 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
分析 A.根据结构简式确定分子式;
B.N分子具有乙烯和甲烷的结构特点;
C.M结构对称,有3种氢原子;
D.有机物都能发生氧化反应,含有碳碳双键的有机物能发生还原反应和加聚反应.
解答 解:A.根据结构简式确定分子式为C9H14,故A错误;
B.N分子具有乙烯和甲烷的结构特点,甲烷中所有原子不共面,所以该物质中所有原子不完全共平面,故B错误;
C.M结构对称,有3种氢原子,其二氯代物有10种,故C错误;
D.有机物都能发生氧化反应,含有碳碳双键的有机物能发生还原反应和加聚反应,这几种物质都能燃烧而发生氧化反应,都含有碳碳双键而能和氢气发生加成反应或还原反应,碳碳双键都能发生加聚反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生分析判断能力,易错选项是C.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
5.下列有关实验的说法不正确的是( )
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
2.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
9.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)Q在元素周期表中的位置是第三周期第ⅢA族.基态Q原子的价电子排布图为 .
.
(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
19.下列能说明碳与氮两元素非金属性相对强弱的是( )
| A. | 相同条件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更稳定 | |
| D. | C与H2的化合价比N2与H2的化合更容易 |
1.等物质的量的金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,己知VB=2VC,且VA=VB+VC,则在A的生成物中.该金属元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
19.把0.2mol/LNH4Cl溶液与0.1mol/LNaOH溶液等体积混合后的溶液中,下列微粒的物质的量浓度的关系不正确的是( )
| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
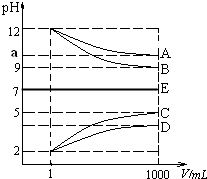 物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:
物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答: