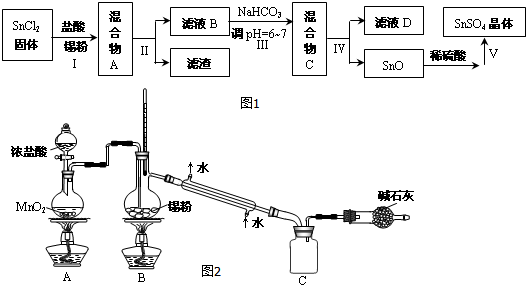
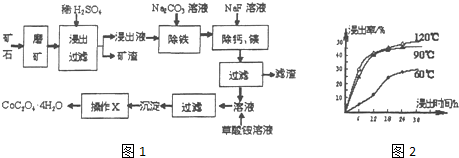
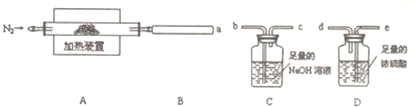
题目内容
9.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.(2)X的氢化物的VSEPR模型为四面体.属于极性 (填“极性”或“非极性”)分子.
(3)根据表中数据推测,Y的原子半径的最小范围是大于0.099nm小于0.143nm.
(4)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙→丙十水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2.
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,请解释原因:铜离子结合水分子变成水合铜离子.
(6)Z晶体的原子堆积模型为体心立方堆积,设Z原子半径为r cm,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3(写出表达式,假设阿伏加德罗常数为NA).
分析 X、Y、Z、M、R、Q是短周期主族元素,由信息可知,常温下X单质为黄色固体,X为S,无机非金属材料的主角可知Y为Si,由焰色反应呈黄色可知Z为Na,M只有-2价,则M为O元素,R的最高价为+7价,则R为Cl,Q的化合价为+3价,且氧化物可做耐火材料,则Q为Al,以此来解答.
解答 解:X、Y、Z、M、R、Q是短周期主族元素,由信息可知,常温下X单质为黄色固体,X为S,无机非金属材料的主角可知Y为Si,由焰色反应呈黄色可知Z为Na,M只有-2价,则M为O元素,R的最高价为+7价,则R为Cl,Q的化合价为+3价,且氧化物可做耐火材料,则Q为Al,
(1)Al位于第三周期第ⅢA族,价电子排布图为 ,故答案为:第三周期第ⅢA族;
,故答案为:第三周期第ⅢA族; ;
;
(2)X的氢化物为H2S,S形成2个S-H,且存在2对孤对电子,则VSEPR模型为四面体,结构不对称,为极性分子,故答案为:四面体;极性;
(3)Si位于第三周期,原子半价介于Al、Cl之间,则大于0.099nm小于0.143nm,故答案为:大于0.099nm小于0.143nm;
(4)甲+乙→丙十水.若丙的水溶液呈碱性,则为NaOH与氢氧化铝的反应生成丙为NaAlO2(或NaOH与硅酸反应生成的Na2SiO3),故答案为:NaAlO2;
(5)M的氢化物是常见溶剂,白色硫酸铜粉末溶解于其中能形成蓝色溶液,是因铜离子结合水分子变成水合铜离子,故答案为:铜离子结合水分子变成水合铜离子;
(6)由原子堆积模型为体心立方堆积可知 ,设Z原子半径为r cm,设棱长为x,则x2+($\sqrt{2}$x)2=(4r)2,解得x=$\frac{4r}{\sqrt{3}}$,在晶胞中含有钠原子数为1+8×$\frac{1}{8}$=2,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3,故答案为:$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$.
,设Z原子半径为r cm,设棱长为x,则x2+($\sqrt{2}$x)2=(4r)2,解得x=$\frac{4r}{\sqrt{3}}$,在晶胞中含有钠原子数为1+8×$\frac{1}{8}$=2,则Z晶体的密度为$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$g/cm3,故答案为:$\frac{2×23}{{N}_{A}(\frac{4r}{\sqrt{3}})^{3}}$.
点评 本题考查位置、结构与性质及晶胞计算,为高频考点,把握元素及化合物的性质推断元素为解答的关键,侧重分析与推断能力的考查,(6)中计算为解答的难点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案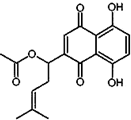 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
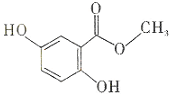
| A. | 分子式为C8H6O4 | B. | 所有的碳原子可能在同一平面内 | ||
| C. | 能发生消去反应 | D. | 能通过加聚反应生成高分子化合物 |
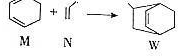 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
| A. | 17L | B. | 20L | C. | 21L | D. | 23L |
| A. | 常温下醋酸易挥发 | |
| B. | 醋酸能与水以任意比互溶 | |
| C. | 常温下0.1mol/L的醋酸钠溶液的pH约为9 | |
| D. | 10mL0.1mol/L的醋酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |