题目内容
19.把0.2mol/LNH4Cl溶液与0.1mol/LNaOH溶液等体积混合后的溶液中,下列微粒的物质的量浓度的关系不正确的是( )| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
分析 0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液的溶质为等物质的量的NH3•H2O、NH4Cl和NaCl,溶液中存在NH3•H2O?NH4++OH-,溶液呈碱性,以此分析该题,
A.0.2mol/LNH4Cl溶液中存在物料守恒,n(Cl)=n(N);
B.溶液的溶质为等物质的量的NH3•H2O、NH4Cl和NaCl,据此分析离子浓度大小;
C.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
D.溶液中电荷守恒和物料守恒计算分析判断;
解答 解:0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液的溶质为等物质的量的NH3•H2O、NH4Cl和NaCl,溶液中存在NH3•H2O?NH4++OH-,溶液呈碱性,溶液中c(NH4+)>c(Na+),由于一水合氨只有小部分电离,所以c(NH3•H2O)>c(OH-),
则微粒的物质的量浓度的关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)
A.0.2mol/LNH4Cl溶液中存在物料守恒,c(Cl-)=c(NH3•H2O)+c(NH4+),故A正确;
B.溶液的溶质为等物质的量的NH3•H2O、NH4Cl和NaCl,离子浓度大小为c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+),故B正确;
C.溶液中存在电荷守恒c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),故C正确;
D.溶液中电荷守恒c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),物料守恒c(Cl-)=c(NH3•H2O)+c(NH4+),代入计算得到c(NH3•H2O)+c(OH-)=c(Na+)+c(H+),故D错误;
故选D.
点评 本题考查溶液离子浓度的大小,题目难度中等,注意氨水为弱电解质的性质,明确混合后溶液中溶质以及它们量的关系是解题的关键.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案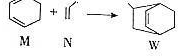 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 棕红色NO2加压后颜色先变深后变浅 |
| A. | 常温下醋酸易挥发 | |
| B. | 醋酸能与水以任意比互溶 | |
| C. | 常温下0.1mol/L的醋酸钠溶液的pH约为9 | |
| D. | 10mL0.1mol/L的醋酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 标况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
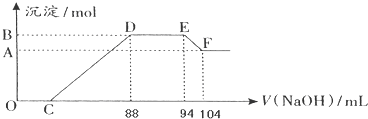
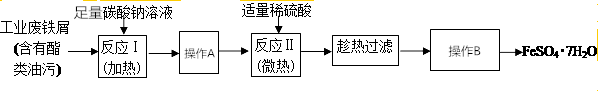
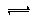 HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.