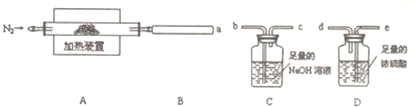
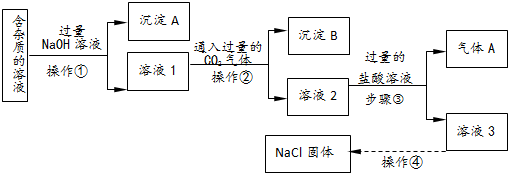
题目内容
18.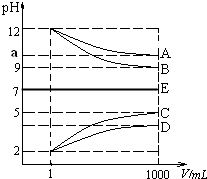 物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:
物质A~E都是由NH4+、H+、Na+、OH-、CH3COO-、Cl-中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答:(1)已知常温下CH3COOH和NH3•H2O 的电离常数相等都等于2×10-5 mol•L-1,E可能为NaCl,CH3COONH4(填化学式).
(2)根据甲图显示的pH的变化关系,写出物质的化学式:CHCl.
(3)25℃时,将amol B溶于水,向其中逐滴滴加D溶液至二者恰好完全反应,溶液显碱性,在滴加D溶液的过程中的水的电离平衡将正向(填”正向”“不”或“逆向”)移动;若向该溶液中又滴加b升 D溶液后溶液呈中性,所滴加D溶液的浓度为$\frac{a}{200b}$mol•L-1.
分析 根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸;
(1)E在稀释过程中pH不变,则E为强酸强碱盐或弱酸弱碱盐,但必须是弱酸弱碱盐中阴阳离子的水解程度相同;
(2)由分析可知C是盐酸;
(3)B是氢氧化钠、D是醋酸,二者恰好反应生成CH3COONa;NaOH溶液中滴加醋酸,溶液中氢氧根离子浓度减小,对水的电离的抑制程度减小;将a mol NaOH溶于水,向该溶液滴加b L CH3COOH后溶液呈中性,则溶液中氢氧根离子浓度为10-7mol/L,根据电荷守恒可知c(Na+)=c(CH3COO-),设混合后溶液体积为1L,c(Na+)=c(CH3COO-)=amol/L,再依据醋酸的电离平衡常数计算得到醋酸浓度.
解答 解:根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,
(1)E溶液呈中性,则E为强酸强碱盐或弱酸弱碱盐,且弱酸和弱碱的电离程度相等,因为醋酸和一水合氨的电离程度相等,所以E可能是NaCl或CH3COONH4,
故答案为:NaCl或CH3COONH4;
(2)通过以上分析知,C是HCl,故答案为:HCl;
(3)B是氢氧化钠、D是醋酸,二者恰好反应生成CH3COONa,醋酸钠在溶液中水解,溶液显碱性;NaOH溶液中滴加醋酸,溶液中氢氧根离子浓度减小,对水的电离的抑制程度减小,水的电离平衡正向移动;
将a mol NaOH溶于水,向该溶液滴加b L CH3COOH后溶液呈中性,则溶液中氢氧根离子浓度为10-7mol/L,根据电荷守恒可知c(Na+)=c(CH3COO-),设混合后溶液体积为1L,c(Na+)=c(CH3COO-)=amol/L,已知醋酸的电离平衡常数取Kb=2×10-5 mol•L-1,则Kb=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{a×1{0}^{-7}}{b×c(C{H}_{3}COOH)}$=2×10-5,
所以c(CH3COOH)=$\frac{a}{200b}$mol/L;
故答案为:碱;正向;$\frac{a}{200b}$.
点评 本题考查了物质的推断,涉及弱电解质的电离、酸碱混合溶液定性判断,明确弱电解质的电离特点推断物质,再结合弱电解质的性质来分析解答,题目难度中等.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案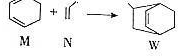 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 棕红色NO2加压后颜色先变深后变浅 |
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 标况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |