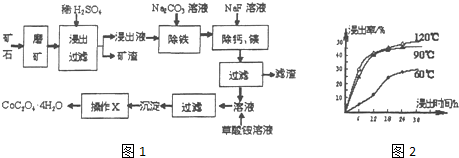
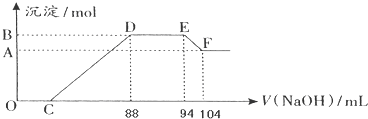
题目内容
1.等物质的量的金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,己知VB=2VC,且VA=VB+VC,则在A的生成物中.该金属元素的化合价为( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 设金属A、B、C再化合物中的化合价分别为x、y、z,金属的物质的量均为n,利用电子守恒得出关系式,再结合VB=2VC,且VA=VB+VC分析金属A在化合物中的化合价.
解答 解:设金属A、B、C再化合物中的化合价分别为x、y、z,金属的物质的量均为n,
由电子守恒可知,
nx=$\frac{{V}_{A}}{22.4L/mol}$×2,
ny=$\frac{{V}_{B}}{22.4L/mol}$×2,
nz=$\frac{{V}_{c}}{22.4L/mol}$×2,
已知VB=2VC,则11.2ny=22.4nz,即y=2z,
且VA=VB+VC,11.2nx=11.2ny+11.2nz,
x=y+z,所以x=3z,
z=1,y=2,x=3符合,
则在A的生成物中,该金属元素的化合价为+3价,
故选C.
点评 本题考查学生利用金属与酸的反应计算元素的化合价,明确电子守恒及体积关系是解答本题的关键,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
14.已知: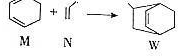 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
1.在120℃时,将1L乙烯、2L甲烷和20L氧气混合点燃,完全燃烧后,恢复到原来的温度,所得气体的体积是( )
| A. | 17L | B. | 20L | C. | 21L | D. | 23L |
6.化学是一门与社会、生活、科研密切相关的自然科学.下列有关叙述中,不正确的是( )
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |