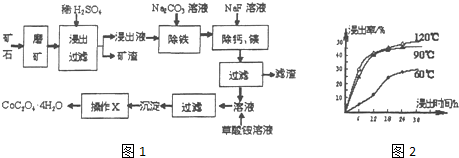
题目内容
2.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
分析 A.标况下乙醇为液态;
B.电解硫酸铜溶液,阳极生成的气体为氧气,根据电子守恒计算出转移的电子数;
C.根据二氧化氮与四氧化二氮存在转化平衡判断;
D.氯气参与反应时可能只做氧化剂被还原,也可能既做氧化剂又做还原剂,发生歧化反应.
解答 解:A.标准状况下,乙醇是液体,不能使用气体摩尔体积计算其物质的量,故A错误;
B.阳极生成的气体为氧气,标准状况下3.36L气体的物质的量为0.15mol,生成0.15mol氧气转移了0.6mol电子,电路中转移电子数为0.6NA,故B正确;
C.30g一氧化氮的物质的量为1mol,16g氧气的物质的量为0.5mol,完全反应生成1mol二氧化氮,由于部分二氧化氮转化成了四氧化二氮,使混合气体的物质的量减小,气体分子数小于NA,故C错误;
D.氯气参与反应时可能只做氧化剂被还原,此时1mol氯气转移2mol电子;但氯气也可能既做氧化剂又做还原剂,发生歧化反应,如在与NaOH溶液的反应中:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气参与反应时转移1mol电子,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是关键,注意气体摩尔体积的使用条件和对象,题目难度不大.

练习册系列答案
相关题目
7.如图为元素周期表的一部分,下列有关短周期元素X,Y,Z,R的叙述正确的是( )

| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | Z的最高价氧化物对应水化物的分子式为H2ZO4 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
14.已知: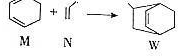 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | W的分子式为C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8种(不考虑立体异构) | |
| D. | M、N、W均可发生氧化反应、还原反应和加聚反应 |
6.化学是一门与社会、生活、科研密切相关的自然科学.下列有关叙述中,不正确的是( )
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
7.下列事实不能用勒沙特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 棕红色NO2加压后颜色先变深后变浅 |