题目内容
3.某同学取不同质量的镁铝合金样品分别与30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
分析 (1)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(2)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(3)根据方程式中转化关系以及原子守恒计算.
解答 解:(1)c组实验中盐酸完全反应,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol
则c(HCl)=$\frac{2×0.03mol}{0.03L}$=2mol/L.
答:盐酸的浓度为2mol/L.
(2)设0.510合金中Mg?Al的物质的量分别为x?y,
由于a组实验中金属完全反应,生成氢气n(H2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,
由合金质量知:x×24g/mol+y×27g/mol=0.510g ①
由反应得失电子数相等得:2x+3y=0.025mol×2 ②
解①②得:x=y=0.01 mol
则合金中镁的质量分数=$\frac{0.01mol×24g/mol}{0.510g}×100%=47.06%$
答:合金中镁的质量分数为47.06%.
(3)c组实验合金中n(Al)=n(Mg)=0.01mol×$\frac{0.918g}{0.510g}$=0.018mol
与盐酸恰好反应后,溶液中只有AlCl3和MgCl2
溶解0.918g合金共需要n(HCl)=0.018 mol×3﹢0.018 mol×2=0.09mol
V(HCl)=$\frac{0.09mol}{2mol/L}=0.045L=45mL$ 答:在c组实验后,还需向容器中加入15mL同浓度的盐酸才能使剩余合金恰好完全溶解.
点评 本题考查了合金的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合原子守恒进行计算,题目难度较大.

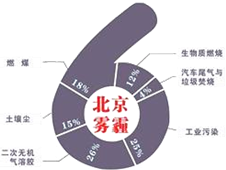 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
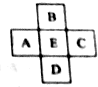 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
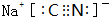 .
.