题目内容
8.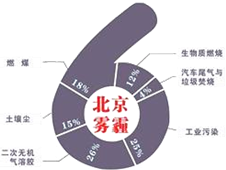 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
分析 A、反应是可逆反应,不能进行彻底;
B、尾气温度已经很高,再升高温度的意义不大;
C、从平衡常数分析反应进行程度,净化设备经济效益分析;
D、提高净化速率的最好方法是使用高效催化剂.
解答 解:A.该反应为可逆反应,不能完全转化,排出的气体中一定含有NO或CO,故A错误;
B.尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,故B错误;
C、因平衡常数已经较大,增大压强虽然平衡正向移动,但对设备要求更高,不符合生成经济效益,故C错误;
D、研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,故C正确;
故选D;
点评 本题考查了化学平衡移动、平衡常数、平衡影响因素等知识点,难度中等,掌握好原理是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.将42g纯醋酸(化学式为CH3COOH,相对分子质量为60)溶解在58g水中,形成密度为1.05g/cm3的溶液,所得溶液中醋酸的物质的量浓度为( )
| A. | 7.35 mol/L | B. | 8.70 mol/L | C. | 10.05 mol/L | D. | 11.40 mol/L |
3.某同学取不同质量的镁铝合金样品分别与30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
通过计算求:
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下烈说法正确的是( )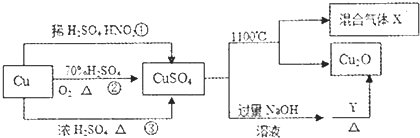

| A. | 途径①、②和③都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是甲醛溶液 | |
| C. | CuSO.在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,因Cu2+水解得不到胆矾晶体 |
17.下列物质的俗称与化学式对应一致的是( )
| A. | 纯碱NaOH | B. | 硫黄SO3 | C. | 铁红Fe2O3 | D. | 苏打NaHCO3 |

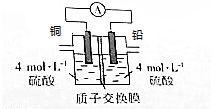 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题: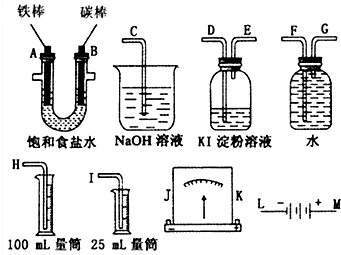 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.