题目内容
14.Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布为msmmpn;③R原子核外L层电子数为奇数;④Q、X原子P轨道的电子数分别为2和4.请回答下列问题:(1)Z原子的外围电子排布式是3d104s1.
(2)将氨水滴入到Z的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,呈深蓝色的离子是[Cu(NH3)4]2+,写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O 或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是b.
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.Q、Y分别与X所形成的晶体类型相同 d.甲是由极性键构成的非极性分子,易溶于水
(4)Q、R、X三种元素的第一电离能由小到大的顺序为:C<O<N(用元素符号作答).
分析 Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,则n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,据此解答.
解答 解:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素,Y原子价电子(外围电子)排布msnmpn,则n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素.
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1,
故答案为:3d104s1;
(2)硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,由于Cu2+可以提供空轨道,NH3可提供孤对电子,形成配离子[Cu(NH3)4]2+,离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O 或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:[Cu(NH3)4]2+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O 或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,
ab.非金属性C>Si,故稳定性CH4>SiH4,二者结构相似,都可以形成分子晶体,相对分子质量越大,沸点越高,故沸点CH4<SiH4,故a错误、b正确;
c.Q、Y分别与X所形成的晶体分别为CO2(或CO)、SiO2,前者属于分子晶体,后者属于原子晶体,故c错误;
d.甲为CH4,由极性键构成,为正四面体对称结构,属于非极性分子,难溶于水,故d错误,
故答案为:b;
(4)同周期自左而右第一电离能增大趋势,氮元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能C<O<N,
故答案为:C<O<N.
点评 本题考查结构性质位置关系应用、核外电子排布规律、元素周期律、配合物、电离能等,推断元素是解题的关键,注意同周期元素第一电离能异常情况.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①分子式符合CxH2x+2Oy
②相对分子质量介于70~100
③氧元素的质量分数为18.18%
④分子中含有2个甲基
⑤能与金属钠反数应放出氢气.
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | 0.5mol | B. | 1.0mol | C. | 1.5mol | D. | 2.0mol |
| A. | 萃取是常用的有机物提纯方法 | |
| B. | 燃烧法是研究确定有机物成分的有效方法之一 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)该盐酸的物质的量浓度?
(2)合金中镁的质量分数?
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
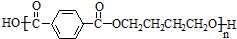
 互为同系物关系.
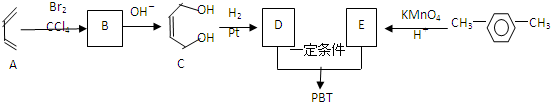
互为同系物关系.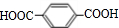 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$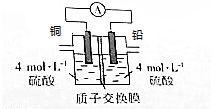 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题: Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.
Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子.